
Wetenschap
Peptide-vingerafdruk maakt eerdere diagnose van de ziekte van Alzheimer mogelijk

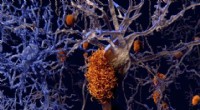
Neurale netwerken kunnen minieme verschillen detecteren in de kleurpatronen van gedroogde peptideoplossingen (links:amyloïde beta (Aβ42) peptide; rechts:mutatie). Krediet:Karlsruhe Institute of Technology
Neurodegeneratieve ziekten zoals de ziekte van Alzheimer of de ziekte van Parkinson worden veroorzaakt door vouwfouten (misfolding) in eiwitten of peptiden, d.w.z. door veranderingen in hun ruimtelijke structuur. Dit is het gevolg van minieme afwijkingen in de chemische samenstelling van de biomoleculen. Onderzoekers van het Karlsruhe Institute of Technology (KIT) hebben een eenvoudige en effectieve methode ontwikkeld om dergelijke misvouwingen in een vroeg stadium van de ziekte op te sporen. Verkeerd vouwen wordt onthuld door de structuur van gedroogde resten van eiwit- en peptideoplossingen. De methode omvat het analyseren van microfoto's met neurale netwerken en heeft een voorspellende nauwkeurigheid van meer dan 99%. De resultaten zijn gepubliceerd in Advanced Materials .
De biochemische structuur van eiwitten en peptiden bepaalt hun biologische functies. Er zijn veel aanwijzingen dat zelfs minieme structurele of ruimtelijke veranderingen de ontwikkeling van ziekten kunnen bevorderen. Veel neurodegeneratieve ziekten zijn toegeschreven aan het verkeerd vouwen van eiwitten en peptiden die door dergelijke veranderingen wordt veroorzaakt. Amyloïde bèta (Aβ42)-peptiden spelen een sleutelrol bij de ziekte van Alzheimer; ze verschillen in een enkel aminozuurresidu en vertegenwoordigen erfelijke mutanten van de ziekte van Alzheimer.
Tot nu toe was er geen eenvoudige en nauwkeurige methode om mutaties in eiwitten te voorspellen. Bij KIT's Institute of Functional Interfaces (IFG) heeft een onderzoeksgroep onder leiding van professor Jörg Lahann een methode ontwikkeld voor het detecteren van misvouwing via de structuur van gedroogde eiwit- en peptideoplossingen. "De kleurpatronen waren niet alleen karakteristiek en reproduceerbaar, maar resulteerden ook in een classificatie van acht mutaties met een voorspellende nauwkeurigheid van meer dan 99%", zegt Lahann, auteur van de studie, bij het beschrijven van de resultaten. De groep toonde aan dat cruciale informatie over de primaire en secundaire structuren van peptiden kan worden verkregen uit de achtergebleven vlekken door druppeltjes peptide-oplossing op een vast oppervlak te drogen.
Vlekpatronen als exacte peptidevingerafdrukken
De eiwit- en peptideoplossingen worden nauwkeurig op glasplaatjes geplaatst door een geautomatiseerd pipetteersysteem om gecontroleerde en reproduceerbare resultaten te garanderen. De oppervlakken van de objectglaasjes waren vooraf voorbereid met een hydrofobe polymeercoating. Om de complexe vlekpatronen van de gedroogde druppeltjes te analyseren, verkregen de onderzoekers beelden met behulp van polarisatiemicroscopie. De beelden werden vervolgens geanalyseerd met diepgaande neurale netwerken.
"Omdat de structuren erg op elkaar lijken en moeilijk te onderscheiden zijn met het blote oog, was het absoluut een verrassing dat de neurale netwerken zo effectief waren", zegt Lahann over de resultaten. "De kleurpatronen van amyloïde beta-peptiden dienen als exacte vingerafdrukken die de structurele en ruimtelijke identiteit van een peptide weerspiegelen." Deze technologie maakt de identificatie van Alzheimer-varianten met maximale resolutie binnen enkele minuten mogelijk, aldus Lahann.
Eenvoudige monstervoorbereiding levert snelle diagnoses op
De resultaten suggereren dat een methode die zo eenvoudig is als het drogen van een druppel peptideoplossing op een vast oppervlak, kan dienen als een indicator voor minieme verschillen in de primaire en secundaire structuren van peptiden. "Schaalbare en nauwkeurige detectiemethoden voor de stratificatie van conformationele en structurele eiwitveranderingen zijn dringend nodig om de pathologische kenmerken van ziekten zoals Alzheimer en Parkinson te decoderen", zegt Lahann.
Het is ook een relatief eenvoudige methode die geen uitgebreide voorbereiding van monsters vereist en dus een eenvoudige en patiëntvriendelijke diagnose mogelijk maakt. Bovendien heeft de methode een groot potentieel voor andere toepassingen in de medische diagnostiek en bij de moleculaire detectie van ziekten. + Verder verkennen
Massaspectrometrie om belangrijke markers van de ziekte van Alzheimer te detecteren
 Hydrogelblokjes ter grootte van een micron laten een zeer efficiënte afgifte zien van een krachtig geneesmiddel tegen kanker
Hydrogelblokjes ter grootte van een micron laten een zeer efficiënte afgifte zien van een krachtig geneesmiddel tegen kanker Het gebruik van kwik in glasthermometers
Het gebruik van kwik in glasthermometers Een materiaal ondersteboven keren kan het soms zachter maken
Een materiaal ondersteboven keren kan het soms zachter maken Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM Er zijn ultrasnelle metaal-ionbatterijen ontwikkeld op basis van nieuw organisch kathodemateriaal
Er zijn ultrasnelle metaal-ionbatterijen ontwikkeld op basis van nieuw organisch kathodemateriaal
 Onze Amazone:Brazilianen die in het grootste regenwoud ter wereld leven
Onze Amazone:Brazilianen die in het grootste regenwoud ter wereld leven Rapport:Grote Meren voelen effecten van snelle klimaatopwarming (update)
Rapport:Grote Meren voelen effecten van snelle klimaatopwarming (update) Wat eet de harp zeehonden?
Wat eet de harp zeehonden?  Opkomende landbouw en landschapsverstoringen bedreigen de doelstellingen van het klimaatakkoord van Parijs
Opkomende landbouw en landschapsverstoringen bedreigen de doelstellingen van het klimaatakkoord van Parijs Geneesmiddelen vormen een wereldwijd milieurisico, experts waarschuwen
Geneesmiddelen vormen een wereldwijd milieurisico, experts waarschuwen
Hoofdlijnen
- DNA-modellen van paperclips maken
- Wat is osmotische lyse?
- Waarom DNA de meest gunstige moleculen is voor genetisch materiaal en hoe RNA zich verhoudt tot deze Respect
- Er is een microklimaat nodig om een pinyonboom te laten groeien
- Veel vis in de zee? Niet noodzakelijk, zoals de geschiedenis laat zien
- Cannabis kweken met moderne wetenschap en technologie
- Structuur van tarwe-immuun-eiwit opgelost:belangrijk hulpmiddel in de strijd om voedselzekerheid
- Wat zijn de functies van de twaalfvingerige darm?
- Insecten plagen met bitterzoete smaak om gewassen te beschermen
- Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
- Gedetailleerde foto laat zien hoe tandglazuur sterk genoeg is om een leven lang mee te gaan

- Van receptorstructuur tot nieuwe osteoporosemedicijnen
- Onderzoekers synthetiseren nieuwe vloeibare kristallen die gerichte transmissie van elektriciteit mogelijk maken

- Onderzoekers onderzoeken energiebesparende katalysatoren die werken bij kamertemperatuur

 Wat is een elektrisch zeil? Nog een exotische manier om het zonnestelsel te verkennen
Wat is een elektrisch zeil? Nog een exotische manier om het zonnestelsel te verkennen NASA ziet Talim nu extra-tropisch
NASA ziet Talim nu extra-tropisch Vierkante meters converteren naar lineaire Metres
Vierkante meters converteren naar lineaire Metres Corrosie van oliepijpleidingen tegengaan door een schurk op nanoschaal te identificeren
Corrosie van oliepijpleidingen tegengaan door een schurk op nanoschaal te identificeren In Parijs, Airbnb beschuldigd van allerlei kwalen
In Parijs, Airbnb beschuldigd van allerlei kwalen Maxwell-Boltzmann Distributie: functie, afleiding & voorbeelden
Maxwell-Boltzmann Distributie: functie, afleiding & voorbeelden  De relatie tussen standaardafwijkingen en percentielen
De relatie tussen standaardafwijkingen en percentielen  Wetenschappers meten nauwkeurig de totale hoeveelheid materie in het universum
Wetenschappers meten nauwkeurig de totale hoeveelheid materie in het universum
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

