
Wetenschap
Een eenvoudigere manier om B-cellen en T-cellen te differentiëren
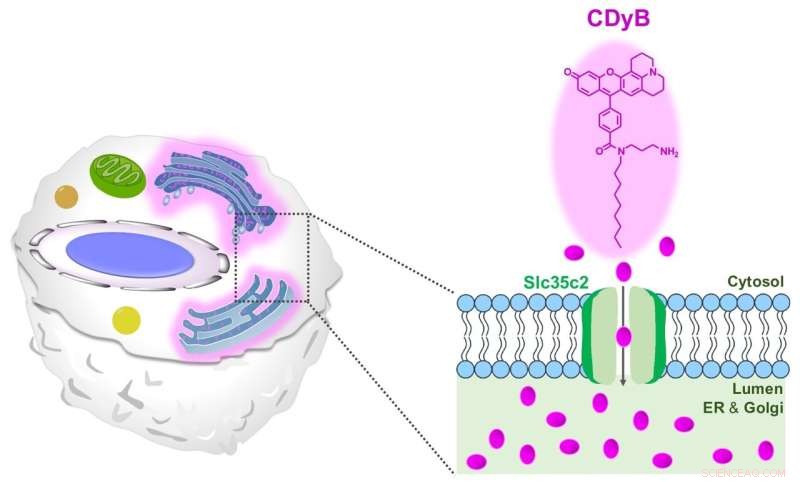
Het voorgestelde kleuringsmechanisme van CDyB. Krediet:Instituut voor Basiswetenschappen
Ons immuunsysteem is essentieel voor onze overleving, omdat ons lichaam voortdurend wordt blootgesteld aan bacteriën, virussen, parasieten en andere ziekteverwekkers. Zonder een immuunsysteem zouden we snel de oorlog tegen deze ziekteverwekkers verliezen en bezwijken voor deze indringers van buitenaf. Het immuunsysteem bestaat uit miljarden individuele witte bloedcellen die in onze bloedbaan circuleren en in onze weefsels bewegen, patrouillerend op tekenen van infectie of weefselbeschadiging. De afweer van het lichaam bestaat uit een groot aantal verschillende soorten witte bloedcellen, waaronder lymfocyten, monocyten en granulocyten. Lymfocyten zijn op hun beurt weer onderverdeeld in T-cellen, B-cellen en NK-cellen.
Identificatie van elk celtype is essentieel voor het begrijpen van hun specifieke rollen en het uitvoeren van onderzoek op het gebied van immunologie. T- en B-lymfocyten zijn twee belangrijke adaptieve immuuncellen in de afweersystemen van ons lichaam. De vergelijkbare grootte en vorm van de cellen maken het echter een uitdaging om ze te onderscheiden. Momenteel wordt het onderscheiden van verschillende celtypes gedaan door cellen te kleuren met behulp van fluorescerende antilichamen die binden aan verschillende clusters van differentiatie (CD) receptoren op het celoppervlak.
Nu heeft een team onder leiding van professor Chang Young-Tae van het Center for Self-assembly and Complexity binnen het Institute for Basic Science in Pohang, Zuid-Korea, met succes een kleine molecule-sonde CDyB ontwikkeld (wat staat voor Compound of Designation geel voor B-cel ) die het onderscheid tussen levende B-cellen en T-cellen kunnen bereiken. CDyB werd ontdekt met behulp van een onbevooroordeelde fluorescentiebibliotheekscreening genaamd Diversity Oriented Fluorescence Library of DOFL. Door dit proces te gebruiken, konden de onderzoekers duizenden verschillende moleculen screenen op hun specificiteit voor het ene type immuuncel boven het andere. Bij toepassing op een mengsel van T- en B-cellen bleek deze nieuwe probe een hoge selectiviteit te hebben voor B-cellen.
CDyB is een nieuw type sonde waarvoor geen CD-specifieke antilichamen nodig zijn om verschillende celtypen te onderscheiden. Het bleek eerder in staat om de cel zelf binnen te gaan en het endoplasmatisch reticulum (ER) en Golgi-apparaat te kleuren, die prominente organellen zijn in de cellen die verantwoordelijk zijn voor het transporteren van materialen in de cellen. Men denkt dat dit mogelijk is dankzij het vermogen van het molecuul om gemakkelijk door celmembranen te gaan.
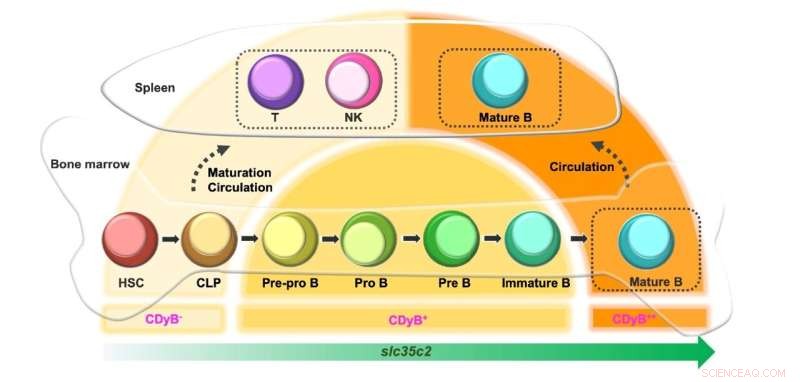
Schematische voorstelling van CDyB fluorescerende intensiteit afhankelijk van de B-cel ontwikkeling. Krediet:Instituut voor Basiswetenschappen
Nadat ze zich realiseerden dat CDyB gelokaliseerd is in de ER / Golgi-organellen, speculeerden de onderzoekers dat het mechanisme van de B-celselectiviteit gebaseerd is op gating. Met andere woorden, sommige transportermoleculen moeten verantwoordelijk zijn voor de opname en accumulatie van de CDyB in de organellen in sommige cellen, maar niet in de andere. Daarom bedachten ze de nieuwe term, gating-georiënteerde live-celdifferentiatie (GOLD) om dit nieuw ontdekte mechanisme voor het onderscheiden van verschillende soorten cellen te beschrijven.
Vervolgens probeerden de onderzoekers erachter te komen waarom CDyB alleen de organellen van de B-cellen kleurt, maar niet de T-cellen. De onderzoekers hebben het mechanisme van de nieuwe sonde verder onderzocht door gebruik te maken van een op SLC-CRISPR gebaseerde bibliotheek, een platform dat een grote kans biedt op systematische opheldering van het doel. Door SLC-CRISPRa en SLC-CRISPRi te gebruiken, ontdekten de onderzoekers dat SLC35C2 de transporter was die specifiek is voor CDyB, waardoor het molecuul in de organellen kan worden getransporteerd. De doeltransporter werd verder gevalideerd door de genexpressieanalyse. De onderzoekers voerden verdere knock-out-experimenten uit en toonden aan dat het verwijderen van de transporter het vermogen van het molecuul om te worden geïnternaliseerd door de ER / Golgi van de doelcellen verwijderde, wat de rol van SlC35C2 voor de B-celselectiviteit aantoonde.
Interessant genoeg merkten de onderzoekers op dat het CDyB-signaal sterker was in rijpe B-cellen dan in onrijpe B-cellen. Dit is hoogstwaarschijnlijk te wijten aan het feit dat de expressie van SLC35C toeneemt naargelang de rijpheid van de B-cellen. De voorlopercellen zoals hematopoëtische stamcellen (HSC) en gewone lymfoïde voorlopercellen (CLP) brengen een laag niveau van SLC35C2 tot expressie en worden dus minimaal gekleurd door CDyB. Wanneer ze differentiëren in T- en NK-cellen, blijft de expressie van SLC35C2 laag, waardoor zwakke CDyB-fluorescentie wordt verkregen. Als de cellen differentiëren in B-cellijnen, neemt de SLC35C2-expressie toe tijdens het rijpingspad. De gedeeltelijk gedifferentieerde B-celvoorlopers (Pre-Pro B, Pro B, Pre B) vertonen matige CDyB-fluorescentie en de volledig gerijpte B-cellen vertonen het hoogste niveau van CDyB-fluorescentie.
Met name heeft het team van professor Chang vorig jaar een andere B-cel-selectieve sonde ontgrendeld, genaamd CDgB (Compound of Designation green for B-cellen). In tegenstelling tot CDyB onderscheidt het B-cellen van T-cellen met behulp van het Lipid-Oriented Live-cell Distinction (LOLD) mechanisme. LOLD gebruikt het kleine verschil in membraancomponenten, zoals koolstofketenlengte en cholesterolgehalte, en flexibiliteit voor celdiscriminatie. Terwijl CDyB sterkere fluorescentie vertoonde in rijpe B-cellen, vertoonde CDgB de helderste kleuring in onrijpe B-cellen vanwege hun zachtere membraanstructuur. Het is te hopen dat het gebruik van beide moleculen met mechanismen samen een effectieve manier kan zijn om verschillende celtypen in bloedcellen te onderscheiden.
Deze studie verrijkt de toolbox voor moleculaire sondes en het moleculaire begrip voor onderscheid tussen levende B-cellen en opent de mogelijkheid van multidimensionale celanalyse op basis van het orthogonale mechanisme met nieuw inzicht. Dit werk is gepubliceerd in de Angewandte Chemie International Edition op 5 juli. + Verder verkennen
Een nieuwe fluorescerende sonde die B-cellen van T-cellen kan onderscheiden
 Een RNA-sleutel die de aangeboren immuniteit ontgrendelt
Een RNA-sleutel die de aangeboren immuniteit ontgrendelt Nieuwe röntgentechnologie kan een revolutie teweegbrengen in de manier waarop artsen afwijkingen identificeren
Nieuwe röntgentechnologie kan een revolutie teweegbrengen in de manier waarop artsen afwijkingen identificeren Hier is een draai aan een eeuwenoude klassieker:Lactosevrije chocolademelk
Hier is een draai aan een eeuwenoude klassieker:Lactosevrije chocolademelk Het bespioneren van eetgewoonten van cellen kan de diagnose van kanker helpen
Het bespioneren van eetgewoonten van cellen kan de diagnose van kanker helpen Onderzoekers rapporteren chemische reactie met potentieel om de ontwikkeling van geneesmiddelen te versnellen
Onderzoekers rapporteren chemische reactie met potentieel om de ontwikkeling van geneesmiddelen te versnellen
Hoofdlijnen
- Waarom walvissen geen hersenbeschadiging oplopen als ze zwemmen
- Europarlementariërs dringen aan op onderzoek naar Monsantos heerschappij over veiligheidsstudies
- Zijn linkshandigen beter in sport?
- Huidige vee-injecties verhogen het risico op letsel, onderzoek vindt
- Morfogenese en de ontwikkeling van levende vormen
- Het verschil van de genomische DNA-extractie tussen dier en plant
- Klimaatverandering veroorzaakt veranderingen in mariene fanerogame populaties
- Nieuwe technologie maakt detectie van eikenverwelking sneller, betaalbaarder
- Wetenschappers rapporteren chemische basis van de celdelingstimer, een mogelijk doelwit tegen kanker
- Onderzoekers lossen een wetenschappelijk mysterie over verdamping op

- Chemicus verkrijgt een nanokatalysatorbasis uit rijstschil

- Dagelijks gebruik voor waterstof

- Klimaatvriendelijke schuimisolatie van gebouwen kan meer kwaad dan goed doen

- Kunstmatige zoetstof kan op een dag kankerbehandelingen bieden met minder bijwerkingen
 Met grafeen gewikkelde zeolietmembranen voor snelle waterstofscheiding
Met grafeen gewikkelde zeolietmembranen voor snelle waterstofscheiding Is je iPhone te fel? Je zou 2020 in de donkere modus moeten beginnen
Is je iPhone te fel? Je zou 2020 in de donkere modus moeten beginnen Microplastics dragen niet bij aan de mobiliteit van organische polluenten in landbouwbodems
Microplastics dragen niet bij aan de mobiliteit van organische polluenten in landbouwbodems Europese stofinput in verband met woestijnvorming in de Sahara en menselijke impact
Europese stofinput in verband met woestijnvorming in de Sahara en menselijke impact Twee piloten, raket wetenschapper, oceanograaf vliegen SpaceX
Twee piloten, raket wetenschapper, oceanograaf vliegen SpaceX Het beëindigen van streaming is slechts de eerste stap naar het ontmantelen van systemisch racisme op scholen in Ontario
Het beëindigen van streaming is slechts de eerste stap naar het ontmantelen van systemisch racisme op scholen in Ontario Wanneer werkt een van de centrale ideeën in de economie?
Wanneer werkt een van de centrale ideeën in de economie? Sterren verschijnen voor de begrafenis van Stephen Hawkings (update)
Sterren verschijnen voor de begrafenis van Stephen Hawkings (update)
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

