
Wetenschap
Moleculaire chaperonne-interacties gevisualiseerd door middel van röntgenstructuuranalyse
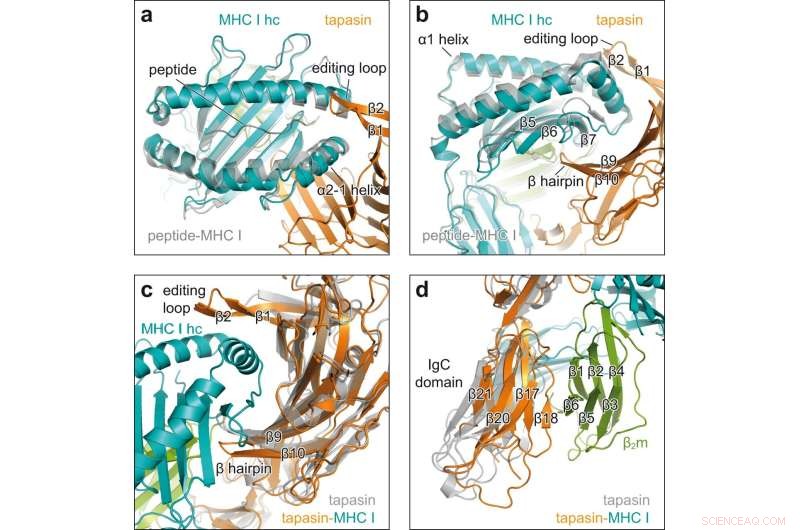
Conformationele veranderingen bij betrokkenheid van klant-begeleider. a Bovenaanzicht van superpositie van peptide-ontvankelijk MHC I in het chaperonne-complex (MHC I hc, teal; tapasin, orange) met peptide-gebonden H2-D b (grijs, VOB ID 2F74) in cartoonweergave. hc zware keten; β1, β2, β strengen bewerkingslus van tapasin. b Zijaanzicht van de superpositie getoond in een β5, β6, β7, β strengen van MHC I hc; β9, β10, β haarspeld van tapasin. c Zicht op de concave interface van tapasine in superpositie van MHC I-gebonden tapasine uit het chaperonnecomplex (tapasine, oranje; MHC I hc, groenblauw; β2m, groen) met cliëntvrije tapasine (grijs, PDB ID 3F8U). d Superpositie zoals in c maar gezien op het C-terminale domein van tapasin. IgC-domein immunoglobuline constant domein, β2 m β2 -microglobuline. Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-32841-9
Als taakgroepen van het adaptieve immuunsysteem zijn T-lymfocyten verantwoordelijk voor het aanvallen en doden van geïnfecteerde of kankercellen. Dergelijke cellen, zoals bijna alle cellen in het menselijk lichaam, presenteren op hun oppervlak fragmenten van alle eiwitten die ze binnenin produceren. Als deze peptiden bevatten die een T-lymfocyt als vreemd herkent, wordt de lymfocyt geactiveerd en doodt de cel in kwestie.
Het is daarom belangrijk voor een robuuste T-celrespons dat geschikte eiwitfragmenten aan de T-lymfocyt worden aangeboden. Het onderzoeksteam onder leiding van Simon Trowitzsch en Robert Tampé van het Instituut voor Biochemie van de Goethe Universiteit Frankfurt heeft nu licht geworpen op hoe de cel deze eiwitfragmenten of peptiden selecteert.
Peptidepresentatie vindt plaats op zogenaamde major histocompatibility complex class I molecules (MHC I). MHC I-moleculen zijn een groep van zeer diverse oppervlakte-eiwitten die talloze verschillende peptiden kunnen binden. Ze zijn verankerd in het celmembraan en vormen met hun naar buiten gerichte deel een peptide-bindende pocket.
Zoals alle oppervlakte-eiwitten nemen MHC I-moleculen de zogenaamde secretoire route:ze worden gesynthetiseerd in het holtesysteem van de cel (endoplasmatisch reticulum (ER) en Golgi-apparaat) en daar gevouwen. Kleine blaasjes ontkiemen dan uit het holtesysteem, migreren naar het celmembraan en versmelten ermee.
Het rijpingsproces van de MHC I-moleculen wordt zeer strikt gecontroleerd:in het ER helpen eiwitten die bekend staan als "chaperonnes" hen te vouwen. De chaperonne tapasin is essentieel voor het laden van peptiden in dit proces.
"Wanneer een MHC I-molecuul een peptide heeft gebonden, controleert tapasin hoe strak de binding is", zegt Trowitzsch, die de taak van de chaperonne uitlegt. "Als de binding onstabiel is, wordt het peptide verwijderd en vervangen door een stevig bindende." Het is echter nog niet mogelijk geweest om duidelijk te maken hoe tapasin deze taak precies uitvoert, vooral omdat het laadproces extreem snel is.
De biochemici en structuurbiologen van de Goethe-universiteit Frankfurt zijn er nu voor het eerst in geslaagd om de kortstondige interactie tussen chaperonne en MHC I-molecuul te visualiseren door middel van röntgenstructuuranalyse.
Hiervoor maakten ze varianten van de twee interactiepartners die niet meer in het membraan zaten, zuiverden ze en brachten ze samen. Een truc hielp om het laadcomplex in actie voor kristallisatie vast te leggen:eerst laadde het onderzoeksteam het MHC I-molecuul met een peptide met hoge affiniteit, zodat een stabiel complex werd gecreëerd.
Een lichtsignaal veroorzaakte splitsing van het peptide, wat het vermogen om het MHC I-molecuul te binden sterk verminderde. Onmiddellijk kwam tapasin op het toneel en bleef gebonden aan het MHC I-molecuul dat zijn peptide mist. "De foto-geïnduceerde splitsing van het peptide was cruciaal voor het succes van ons experiment", zegt Tampé. "Met behulp van deze optochemische biologie kunnen we nu systematisch complexe cellulaire processen één voor één reproduceren."
Röntgenstructuuranalyse van de kristallen onthulde hoe tapasine de peptide-bindende pocket van het MHC I-molecuul verwijdt, waardoor de sterkte van de peptidebinding wordt getest. Hiervoor vormen de interactiepartners een groot contactgebied; voor stabilisatie zit een lus van tapasin bovenop de verbrede bindzak.
"Dit is de eerste keer dat we het laadproces met een hoge resolutie hebben laten zien", zegt Tampé. De beelden laten ook zien hoe een enkele chaperonne kan interageren met de enorme diversiteit aan MHC I-moleculen, zegt de biochemicus. "Tapasine bindt precies de niet-variabele regio's van de MHC I-moleculen." De nieuwe structuur verbetert echter niet alleen ons begrip van de complexe processen die betrokken zijn bij het laden van MHC I-moleculen. Het zou ook moeten helpen bij het selecteren van geschikte kandidaten voor de ontwikkeling van vaccins.
Het onderzoek is gepubliceerd in Nature Communications . + Verder verkennen
Verkeersborden voor immuunafweercellen
 Industriële verbinding krijgt milieuvriendelijke reactie
Industriële verbinding krijgt milieuvriendelijke reactie Een kleur van poreuze materialen in- en uitschakelen met zuur
Een kleur van poreuze materialen in- en uitschakelen met zuur Het meest nauwkeurige beeld van Zika tot nu toe creëert potentieel voor therapieën
Het meest nauwkeurige beeld van Zika tot nu toe creëert potentieel voor therapieën Afvalwarmte benutten voor elektriciteit door nanostructurering van thermo-elektrische materialen
Afvalwarmte benutten voor elektriciteit door nanostructurering van thermo-elektrische materialen Bioprinted aderen onthullen nieuwe details over medicijndiffusie
Bioprinted aderen onthullen nieuwe details over medicijndiffusie
 Indonesië stuurt containers met afval terug naar Frankrijk, Hongkong
Indonesië stuurt containers met afval terug naar Frankrijk, Hongkong Variabiliteit in vegetatiefenologie op basis van boomringgegevens van het Tibetaanse plateau
Variabiliteit in vegetatiefenologie op basis van boomringgegevens van het Tibetaanse plateau Stedelijke ontwikkeling vermindert de kans op plotselinge overstromingen in het droge Westen
Stedelijke ontwikkeling vermindert de kans op plotselinge overstromingen in het droge Westen Mysterieziekte verspreidt zich, bedreigt koraalriffen in Lower Florida Keys
Mysterieziekte verspreidt zich, bedreigt koraalriffen in Lower Florida Keys Indonesië begint met cloud seeding om bosbranden op afstand te houden
Indonesië begint met cloud seeding om bosbranden op afstand te houden
Hoofdlijnen
- Aan vuur aangepaste insecten maken optimaal gebruik van door bosbranden gesteriliseerde broedplaatsen
- Betere mensen maken - Het huwelijk tussen mens en machine
- Dode bomen leven met schimmels
- Hoeveel Valence-elektronen heeft natrium?
- Wat is het doel van de fibreuze capsule?
- Onderzoeksgroep ontdekt de oorsprong van octopussen onmiddellijke modulatie van lichaamskleuring
- Hoe is de concentratie van een oplossing van invloed op osmose?
- Wetenschappers vinden potentiële wapens voor de strijd tegen antibioticaresistentie
- Zeeslakken weten hoe ze hun huisvestingskosten moeten begroten
- Een ongebruikelijke vorm van antibioticaresistentie bij pandemische cholera
- Snelle tests voor vroege diagnose van hartaanvallen en identificatie van sepsis

- Waarom sommige groenen bruin worden in historische schilderijen

- Hernieuwbare hulpbron:om vitaal liponzuur te produceren, zwavel wordt gebruikt, dan bijgevuld
- De nullen van een functie vinden

 Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien
Rekbare supercondensatoren om de draagbare apparaten van morgen van stroom te voorzien Onderzoekers ontwikkelen nieuwe methode om superfluïde beweging te detecteren
Onderzoekers ontwikkelen nieuwe methode om superfluïde beweging te detecteren Natuurkundigen ontwerpen nieuw pand uit wit grafeen
Natuurkundigen ontwerpen nieuw pand uit wit grafeen Uit onderzoek blijkt dat wassen effectief lood verwijdert uit groenten die in stedelijke grond worden verbouwd
Uit onderzoek blijkt dat wassen effectief lood verwijdert uit groenten die in stedelijke grond worden verbouwd EU begint bloedig harde strijd om groene ambitie te bereiken
EU begint bloedig harde strijd om groene ambitie te bereiken Studie van gesteentemonsters suggereert dat Campi Flegrei opnieuw een nieuwe fase van drukopbouw zou kunnen ingaan
Studie van gesteentemonsters suggereert dat Campi Flegrei opnieuw een nieuwe fase van drukopbouw zou kunnen ingaan Vooruitgang in de ontwikkeling van oplaadbare batterijen door middel van nanotechnologie
Vooruitgang in de ontwikkeling van oplaadbare batterijen door middel van nanotechnologie Links met ongelijkheid thuisonderwijs zijn verre van nieuw
Links met ongelijkheid thuisonderwijs zijn verre van nieuw
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

