
Wetenschap
De elektrische handtekening van fosfaten helpt bij het detecteren van belangrijke mobiele gebeurtenissen

Grafisch abstract. Krediet:Tokyo Tech
Elke dag vinden er op cellulair niveau miljoenen biologische processen plaats in ons lichaam. Het bestuderen van deze processen kan ons helpen meer te weten te komen over hoe cellen functioneren, een vakgebied dat onderzoekers is blijven intrigeren. Sinds kort is er echter een nieuwe speler op dit gebied. Een nieuwe analytische methode - detectie van één molecuul - heeft aan kracht gewonnen vanwege het succes bij het observeren van specifieke, biologisch relevante moleculen en de bijbehorende processen.
Wetenschappers hebben manieren geprobeerd om detectie-assays met één molecuul te gebruiken om eiwitten en hun post-translationele modificaties (PTM's) te bestuderen. PTM's zijn enzymatische veranderingen die worden waargenomen na eiwitsynthese, waarbij functionele groepen worden toegevoegd aan de aminozuren in het eiwit, waardoor het een specifieke functie kan uitoefenen.
De studie van PTM's kan ons helpen celsignalering en de oorsprong van verschillende ziekten te begrijpen. Echter, assays die hierop gericht zijn, moeten zeer selectief en specifiek voor dat eiwit zijn. Gezien het gebrek aan gevoeligheid van de huidige technieken, is het een uitdaging om PTM-metingen met één molecuul te verkrijgen.
Onlangs hebben onderzoekers van het Tokyo Institute of Technology (Tokyo Tech) een "elektrerende" manier gevonden om deze beperkingen te overwinnen. In hun recente doorbraak, gepubliceerd in het Journal of the American Chemical Society , rapporteerde een team van wetenschappers onder leiding van universitair hoofddocent Tomoaki Nishino van Tokyo Tech de detectie van fosforylering met één molecuul in peptiden - korte aminozuurketens - en de vorming van een orthofosfaatverbinding met behulp van elektronische handtekeningen.
Dr. Nishino legt uit:"We kozen voor peptidefosforylering, een archetypisch en biologisch relevant PTM, voor onze detectiestudies. Het doel was om een hulpmiddel te ontwikkelen dat zelfs de kleinste wijziging in de chemische structuur van aminozuren zou kunnen detecteren."
Om te beginnen bestudeerde het team de elektronische eigenschappen van gefosforyleerde peptiden met behulp van hun anorganische analoog, orthofosforzuur (H3 PO4 ). Ze maakten een fosfaatoplossing (PO4 3- ) en onderwierp het aan een scanning tunneling microscope (STM)-assisted break-junction (BJ) techniek. Toen de stroom tussen twee gouden STM-elektroden werd geleid, bleek een orthofosfaatgroep de nanogap tussen de elektroden te overbruggen door een stabiele verbinding te vormen vanwege de interactie van de negatief geladen zuurstofatomen met het goud. Het was dit kruispunt en zijn handtekening die verdere experimenten dreven.
De single-orthofosfaatovergang bleek een hoge geleidbaarheid van 0,4 G0 te hebben en verschillende elektronische eigenschappen, waarvan de laatste het mogelijk maakte dat deze procedure zeer specifiek was en het PTM in kwestie nauwkeurig kon detecteren (d.w.z. fosforylering). Om hun techniek verder te testen, voerde het team in situ fosforylatie-assays met één molecuul uit, waarbij ze onderscheid konden maken tussen gefosforyleerde en niet-gefosforyleerde peptiden met een nauwkeurigheid van 95% en een specificiteit van 91%.
De methode die in deze studie wordt gedemonstreerd, biedt een onvoorzien perspectief in de wereld van PTM's in eiwitten. Deze nieuwe techniek zal ook nieuwe wegen openen voor het gebruik van single-molecule detectie van PTM's in klinische diagnose en farmaceutische toepassingen.
"Er is een sterk verband tussen eiwitfosforylering en de pathogenese van een breed scala aan ziekten. Met onze methode kunnen wetenschappers ontrafelen hoe fosforylering de cellulaire gebeurtenissen reguleert die leiden tot de oorsprong van een ziekte en daardoor helpen bij de ontwikkeling van behandelingen." concludeert Dr. Nishino. + Verder verkennen
Naar zelfherstellende elektronische apparaten met lange DNA-moleculen
 Dubbelbedkatalysator maakt een hoge omzetting van syngas in vloeibare koolwaterstoffen in het benzinebereik mogelijk
Dubbelbedkatalysator maakt een hoge omzetting van syngas in vloeibare koolwaterstoffen in het benzinebereik mogelijk PH-waarden aanpassen
PH-waarden aanpassen  Bouwstenen van DNA en RNA hadden samen kunnen verschijnen voordat het leven op aarde begon
Bouwstenen van DNA en RNA hadden samen kunnen verschijnen voordat het leven op aarde begon Elektronische neus om honden te snuffelen voor dodelijke tropische ziekte in Brazilië
Elektronische neus om honden te snuffelen voor dodelijke tropische ziekte in Brazilië Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies
Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies
 NASA ziet Iris de Zombie Storm herboren in de buurt van Queensland
NASA ziet Iris de Zombie Storm herboren in de buurt van Queensland Ohios Serpent Mound is een archeologisch mysterie
Ohios Serpent Mound is een archeologisch mysterie Trump-team stelt voor om woestijnbescherming terug te draaien om geothermische energie te stimuleren
Trump-team stelt voor om woestijnbescherming terug te draaien om geothermische energie te stimuleren VS halen Saoedi-Arabië in als producent van ruwe olie:IEA
VS halen Saoedi-Arabië in als producent van ruwe olie:IEA Op zoek naar betere richtlijnen voor het inventariseren van de uitstoot van broeikasgassen
Op zoek naar betere richtlijnen voor het inventariseren van de uitstoot van broeikasgassen
Hoofdlijnen
- Op de maat blijven is gekoppeld aan reproductief succes bij mannelijke rotsklipdassen
- Het bestuderen van circadiane ritmes in planten en hun ziekteverwekkers kan leiden tot precisiegeneeskunde voor mensen
- Testen wijst uit dat Michigan-honden die ziek maken, parvovirus zijn
- Wat doet de Nucleolus in interfase?
- Convergente evolutie van mimetische vlinders verwart classificatie
- Aan vuur aangepaste insecten maken optimaal gebruik van door bosbranden gesteriliseerde broedplaatsen
- Biologen onderzoeken de moleculaire onderbouwing van cellen die herstellen van de rand van geprogrammeerde dood
- Het overbruggen van twee veelvraatpopulaties in Fennoscandia is noodzakelijk voor het behoud
- Nieuwe slangensoort verstopt zich in het volle zicht
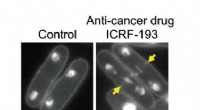
- Antikankermechanisme onthuld in gistexperimenten
- 3D-geprint materiaal ter vervanging van ivoor voor restauratie van artefacten

- Wetenschappers schakelen bakkersgist in op jacht naar nieuwe medicijnen
- Kleverig als het nat is:sterke kleefstof voor wondgenezing
- Wetenschappers vinden verband tussen belangrijk plantenaminozuur en essentiële hormonen

 De koolstofbelasting in Zuid-Afrika is belangrijk voor de economie en de aanpak van klimaatverandering
De koolstofbelasting in Zuid-Afrika is belangrijk voor de economie en de aanpak van klimaatverandering Op zoek naar het verlichtingsmateriaal van de toekomst
Op zoek naar het verlichtingsmateriaal van de toekomst Nanocaviteit en atomair dunne materialen verbeteren technologie voor lichtbronnen op chipschaal
Nanocaviteit en atomair dunne materialen verbeteren technologie voor lichtbronnen op chipschaal Prehistorische blingbling? Esthetiek cruciale factor bij de ontwikkeling van de vroegste koperlegeringen
Prehistorische blingbling? Esthetiek cruciale factor bij de ontwikkeling van de vroegste koperlegeringen Zonnewijzers voor kinderen maken
Zonnewijzers voor kinderen maken Onderzoek blijft vooruitgang tonen in DNA-computing
Onderzoek blijft vooruitgang tonen in DNA-computing Groenere methoden voor het maken van populaire nanodeeltjes
Groenere methoden voor het maken van populaire nanodeeltjes Ook tijdens de lockdown, Californië gaat vrachtvervoer koolstofarm maken
Ook tijdens de lockdown, Californië gaat vrachtvervoer koolstofarm maken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

