Wetenschap
Antikankermechanisme onthuld in gistexperimenten
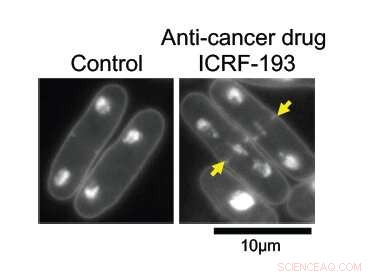
Met DNA-topoisomerase II (topo II) intact, DNA in splijtingsgistcellen repliceert normaal en wordt gelijkmatig verdeeld tussen twee dochtercellen (links). Wanneer onder de effecten van antikankergeneesmiddel ICRF-193, het DNA raakt verstrikt in het midden van de oudercel, het voorkomen van zijn schone verdeling. Krediet:Okinawa Institute of Science and Technology Graduate University
Net als schoenveters of hangende kettingen, DNA-strengen kunnen in onhandelbare knopen verstrikt raken. Gespecialiseerde enzymen houden DNA georganiseerd wanneer cellen delen, zodat de cellen soepel splitsen en niet vast komen te zitten. Maar in tumorcellen deze failsafe zorgt ervoor dat kanker zich kan verspreiden. Nutsvoorzieningen, wetenschappers van de Okinawa Institute of Science and Technology Graduate University (OIST) hebben geleerd hoe dit mechanisme werkt in splijtingsgist en hoe het kan worden ondermijnd bij kanker bij de mens.
De studie, online gepubliceerd op 11 januari, 2019 door de Tijdschrift voor biologische chemie , richt zich op een gevestigd doelwit van kankertherapie:DNA-topoisomerase II, of kortweg topo II. Topo II regelt de topologie van DNA, het beheren van de veranderende structuur van de strengen in de loop van de tijd. Kankercellen vertonen verhoogde topo II-activiteit, wat op zijn beurt de tumorgroei stimuleert. Topo II-geneesmiddelen tegen kanker onderdrukken de functie van het enzym, voorkomen dat tumorcellen zich vermenigvuldigen en de verspreiding van kanker belemmeren.
Maar bestaande topo II-medicijnen hebben beperkt succes laten zien - wetenschappers moeten meer weten over het basismechanisme voordat ze het effectief kunnen afzwakken.
"Veel onderzoekers werken aan topo II, maar ze gebruiken voornamelijk menselijke of hogere eukaryote cellen, " zei Dr. Norihiko Nakazawa, eerste auteur van de studie en een stafwetenschapper in de OIST G0 Cell Unit, onder leiding van prof. Mitsuhiro Yanagida. De eenheid koos ervoor om topo II in splijtingsgist te bestuderen omdat de celdelingsmechanismen ervan grotendeels behouden blijven bij mensen, hij zei, behalve dat het snel en gemakkelijk te manipuleren is.
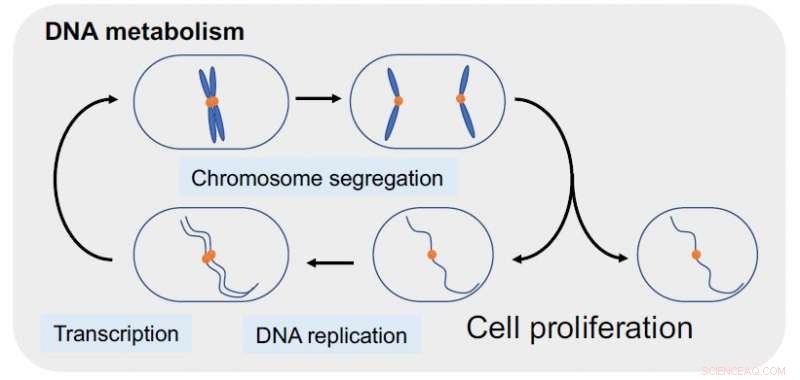
DNA-topoisomerase II (topo II), een hoofdregulator van het DNA-metabolisme voor celproliferatie, is een cruciaal doelwit voor antikankertherapie. Krediet:Okinawa Institute of Science and Technology Graduate University
"We kunnen de topo II-reactie snel vastleggen in gist, ga dan verder om het in menselijke cellen te bestuderen, " zei Nakazawa. "Ons werk toont aan dat gist een goed model is om topo II-geneesmiddelen te screenen en een snelle methode zou zijn om in klinische toepassingen te gebruiken."
De werkzaamheid van geneesmiddelen tegen kanker verhogen
De onderzoekers wilden leren hoe topo II op moleculair niveau werkt. Bij hogere vergrotingen, de effecten zijn duidelijk; cellen met het intacte enzym delen normaal, met de helft van hun gerepliceerde genetische materiaal aan elke kant van de splitsing. Zonder topo II, het DNA blijft verward in het midden van de oudercel, het voorkomen van de juiste verdeling in twee dochtercellen.
Voorafgaand onderzoek suggereert dat topo II afhankelijk is van fosforylering - de toevoeging van een fosfaatgroep op precieze locaties in zijn structuur. In splijtingsgist en menselijke cellen, het enzym caseïnekinase II, ook bekend als CKII, stappen in om specifieke regio's van topo II te fosforyleren. In dit werk, Nakazawa identificeerde deze regio's en ontdekte dat sommige gedurende de hele celcyclus gefosforyleerd bleven. Deze constante chemische uitwisseling verhoogde de activiteit in een gebied van topo II dat bekend staat als het "ATPase-domein". Hoewel de onderzoekers de verbetering waarnamen, aanvankelijk, ze konden niet zeggen hoe het de topo II-functie daadwerkelijk veranderde.
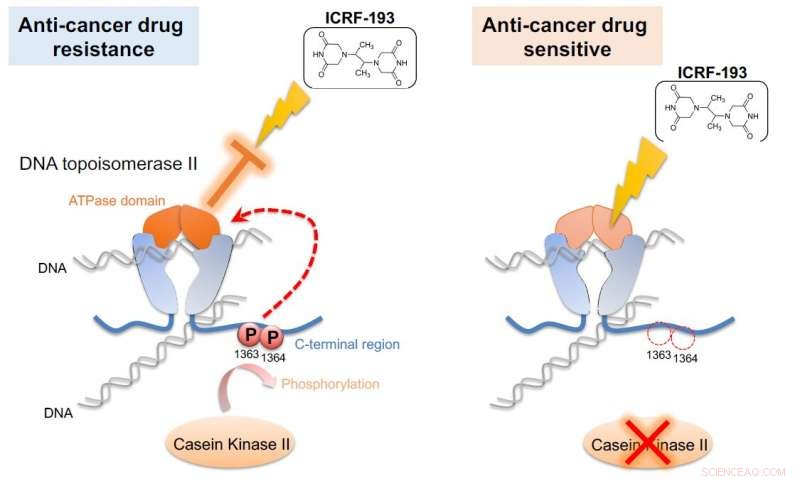
Caseïnekinase II (CKII) fosforyleert DNA-topoisomerase II (topo II), waardoor het ATPase-domein van het enzym wordt geactiveerd (links). Deze activering heft de effecten van het antikankergeneesmiddel ICRF-193 op. Als CKII-activiteit is verzwakt (rechts), de werkzaamheid van ICRF-193 is gered. De G0 Cell Unit demonstreerde dit mechanisme in splijtingsgist, een eenvoudig model dat kan worden gebruikt voor het screenen van geneesmiddelen tegen kanker. Krediet:Okinawa Institute of Science and Technology Graduate University
De wetenschappers losten de puzzel op door een topo II-medicijn in de mix te gooien. Het medicijn ICRF-193 werkt door de ATPase-activiteit van topo II te remmen, die DNA effectief in een strakke configuratie opsluit, zodat het geen enzymatische reacties kan uitvoeren. Maar in aanwezigheid van CKII, die ATPase-activiteit verhoogt, het medicijn wordt ondoeltreffend gemaakt.
"Deze [ATPase-domein]-verbetering brak het effect van het medicijn tegen kanker, " zei Nakazawa. "Als we de fosforylering blokkeren, deze activering gebeurt niet en het medicijn blijft effectief."
Potentiële basis voor nieuwe therapieën
Er zijn aanwijzingen dat topo II en CKII een interactie aangaan in menselijke cellen, net als in splijtingsgist. Kankercellen brengen hogere niveaus van zowel topo II als CKII tot expressie dan normale weefsels, en beide enzymen zijn in verband gebracht met abnormale celproliferatie. Nu wetenschappers het onderliggende mechanisme in gist begrijpen, ze kunnen die kennis toepassen in toekomstige studies in menselijke kankercellen. op een dag, het onderzoek kan leiden tot nieuwe kankerbehandelingen.
"Als we CKII en topo II remmen, het kan een zeer effectieve manier zijn om de celdeling van kanker te remmen, " zei Nakazawa. "Dit additieve effect zou zeer krachtig kunnen zijn bij kankertherapie."
Hoofdlijnen
- Studie beantwoordt een al lang bestaand mysterie over slangenpredatie
- Hoe zal de aarde er over 50 uitzien,
- Welke moleculen kunnen er zonder hulp door het plasmamembraan passeren?
- Feiten over Prokaryotic
- Hoe een microscoop te gebruiken om cellen te zien
- Biohazard-afval verwijderen
- Wat zijn sommige Cell Organelle-analogieën?
- Parasieten en gastheren kunnen anders reageren op een warmere wereld
- Twee muziekbloemlezingen nu voor eeuwig opgeslagen in DNA
 3D-printer met nano-precisie
3D-printer met nano-precisie De eerste chemische geheugeneenheid van één bit - de chit
De eerste chemische geheugeneenheid van één bit - de chit Kleiner dan verwacht fytoplankton kan betekenen dat er minder koolstof wordt vastgelegd op de zeebodem
Kleiner dan verwacht fytoplankton kan betekenen dat er minder koolstof wordt vastgelegd op de zeebodem Raciale vooroordelen erger bij politiemoorden op oudere, mentaal ziek, ongewapende mannen
Raciale vooroordelen erger bij politiemoorden op oudere, mentaal ziek, ongewapende mannen Google-zoekopdrachten onthullen waar mensen zich het meest zorgen maken over klimaatverandering
Google-zoekopdrachten onthullen waar mensen zich het meest zorgen maken over klimaatverandering Onderzoekers betwisten onze aannames over de effecten van planetaire rotatie
Onderzoekers betwisten onze aannames over de effecten van planetaire rotatie Beta Cephei-type pulsaties gedetecteerd in V453 Cygni
Beta Cephei-type pulsaties gedetecteerd in V453 Cygni Onderzoekers onthullen een ongrijpbaar magnetisch signaal op atomaire schaal in een Mott-isolator
Onderzoekers onthullen een ongrijpbaar magnetisch signaal op atomaire schaal in een Mott-isolator
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com