
Wetenschap
Katalyseren van de omzetting van biomassa naar biobrandstof
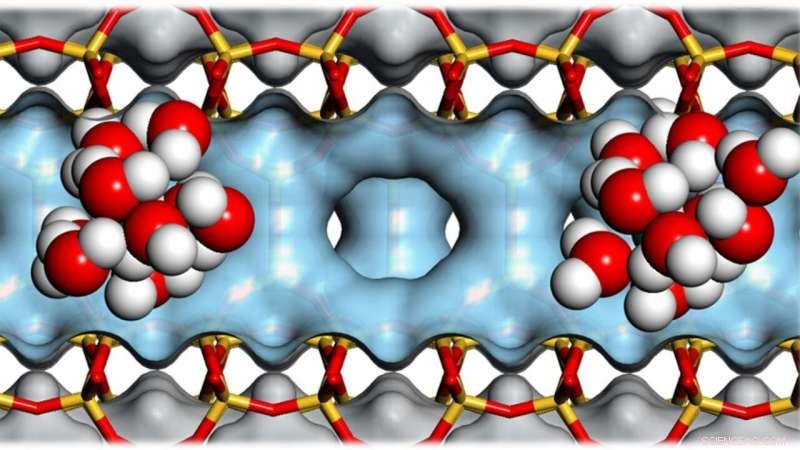
Clusters van watermoleculen in de holten van zeolieten helpen bij het katalyseren van de omzetting van biomassa in biobrandstof. Krediet:Andreas Jentys / TUM
Zeolieten zijn extreem poreuze materialen:tien gram kan een inwendig oppervlak hebben ter grootte van een voetbalveld. Door hun holtes zijn ze nuttig bij het katalyseren van chemische reacties en zo energie te besparen. Een internationaal onderzoeksteam heeft nu nieuwe bevindingen gedaan over de rol van watermoleculen in deze processen. Een belangrijke toepassing is de omzetting van biomassa in biobrandstof.
Brandstof gemaakt uit biomassa wordt als klimaatneutraal beschouwd, hoewel er nog steeds energie nodig is om het te produceren:de gewenste chemische reacties vereisen hoge niveaus van temperatuur en druk.
"Als we in de toekomst zonder fossiele energiebronnen willen en op grote schaal efficiënt gebruik willen maken van biomassa, we zullen ook manieren moeten vinden om de energie die nodig is voor de verwerking van de biomassa te verminderen, " zegt Johannes Lercher, hoogleraar Chemische Technologie aan de Technische Universiteit van München (TUM) en directeur van het Instituut voor Geïntegreerde Katalyse aan het Pacific Northwest National Laboratory in Richland, Washington (VS).
In samenwerking met een internationaal onderzoeksteam, Lercher heeft de rol van watermoleculen in reacties in de poriën van de zeoliet nader bekeken, die kleiner zijn dan een nanometer.
Het begint allemaal met zuren
Een kenmerk van een zuur is dat het gemakkelijk protonen afstaat. Dus, wanneer toegevoegd aan water, zoutzuur splitst in negatief geladen chloride-anionen, zoals die gevonden worden in tafelzoutkristallen, en positief geladen protonen die zich hechten aan de watermoleculen. Dit resulteert in een positief geladen hydroniumion, die dit proton verder wil doorgeven, bijvoorbeeld aan een organisch molecuul.
Wanneer het organische molecuul wordt "gedwongen" om een proton te accepteren, het probeert zichzelf te stabiliseren. Dus, een alcohol kan aanleiding geven tot een molecuul met een dubbele binding - een typische reactiestap op het pad van biomassa naar biobrandstof. De zeolietwanden stabiliseren overgangstoestanden die optreden tijdens conversie en, dus, helpen om de hoeveelheid energie die nodig is om de reactie te laten plaatsvinden te minimaliseren.

Prof. Lercher in zijn laboratorium bij de afdeling Scheikunde van de Technische Universiteit van München. Krediet:Andreas Heddergott / TUM
Zeolieten die als zuren werken
Zeolieten bevatten zuurstofatomen in hun kristalstructuur die al een proton dragen. Net als moleculaire zuren vormen ze hydroniumionen door de interactie met water.
Echter, terwijl hydroniumionen in water dispergeren, ze blijven nauw verbonden met de zeoliet. Chemische voorbehandeling kan het aantal van deze actieve centra variëren en, dus, een bepaalde dichtheid van hydroniumionen in de poriën van de zeoliet tot stand brengen.
De ideale zeoliet voor elke reactie
Door de grootte van de holtes systematisch te variëren, de dichtheid van de actieve plaatsen en de hoeveelheid water, het onderzoeksteam was in staat om de poriegroottes en concentraties van water op te helderen die geselecteerde voorbeeldreacties het best katalyseerden.
"In het algemeen, het is mogelijk om de reactiesnelheid te verhogen door de poriën kleiner te maken en de ladingsdichtheid te verhogen, " Johannes Lercher legt uit. "Echter, deze toename heeft zijn grenzen:als het te druk wordt en de ladingen te dicht bij elkaar komen, de reactiesnelheid daalt weer. Dit maakt het mogelijk om voor elke reactie de optimale omstandigheden te vinden."
"Zeolieten zijn over het algemeen geschikt als nanoreactoren voor alle chemische reacties waarvan de reactiepartners in de poriën passen en waarbij een zuur als katalysator wordt gebruikt, " benadrukt Lercher. "We staan helemaal aan het begin van een ontwikkeling met het potentieel om de reactiviteit van moleculen zelfs bij lage temperaturen te verhogen en, dus, om aanzienlijke hoeveelheden energie te besparen bij de productie van brandstoffen of chemicaliën."
 Geneesmiddelontdekking:eerste rationele strategie om moleculaire lijmafbrekers te vinden
Geneesmiddelontdekking:eerste rationele strategie om moleculaire lijmafbrekers te vinden Nieuwe katalysator maakt styreenproductie goedkoper, groener
Nieuwe katalysator maakt styreenproductie goedkoper, groener Onderzoekers identificeren de innerlijke werking van cellulaire calciumpompen
Onderzoekers identificeren de innerlijke werking van cellulaire calciumpompen De voordelen van seriële verdunning
De voordelen van seriële verdunning  Woorden die u kunt maken met behulp van het periodiek systeem
Woorden die u kunt maken met behulp van het periodiek systeem
 Wat zijn de natuurlijke rijkdommen van het loofbos?
Wat zijn de natuurlijke rijkdommen van het loofbos?  Het effect van alcohol op planten
Het effect van alcohol op planten New Orleans onder avondklok omdat het zuiden van de VS overeenkomt met de schade door orkaan Ida
New Orleans onder avondklok omdat het zuiden van de VS overeenkomt met de schade door orkaan Ida Klimaatwetenschap geteisterd door kantelpunten
Klimaatwetenschap geteisterd door kantelpunten Aardmagnetisch veld gemeten met kunstmatige sterren op 90 kilometer hoogte
Aardmagnetisch veld gemeten met kunstmatige sterren op 90 kilometer hoogte
Hoofdlijnen
- Door het uitbreiden van het DNA-alfabet kunnen cellen nieuwe eiwitten produceren
- Een licht schijnen op bacteriële celdeling
- Soorten forensische tests
- Op pinguïn gemonteerde video legt gastronomische ontmoetingen van het gelatineuze soort vast
- Verschil tussen bacterie- en plantencel Wall
- Wat is interfase, metafase en anafase?
- Onderwaterkwekerijen helpen de mediterrane visbestanden nieuw leven in te blazen
- Wetenschap verklaart de kleur van je kerst
- Noord-Amerikaanse primeur:onderzoekers publiceren wetenschappelijke studie over cannabisproductie
- Nieuw proces maakt biologisch afbreekbare kunststoffen echt composteerbaar

- Onderzoekers bootsen twee natuurlijke energieprocessen na met een enkele katalysator
- Zeeslakverbinding vermindert het risico op kanker

- Metaalgekatalyseerde toevoeging van verzadigde koolstof aan CC-bindingen:een relevante reactie voor de synthese van type II polyketiden
- Gram omzetten in moleculen

 Het modelleren van de beweging van spanen die bij het boren van wapens worden geproduceerd, laat zien dat een eenvoudige hoekverandering kan leiden tot een beter ontwerp van de kanonboor
Het modelleren van de beweging van spanen die bij het boren van wapens worden geproduceerd, laat zien dat een eenvoudige hoekverandering kan leiden tot een beter ontwerp van de kanonboor Oorlog tegen plastic leidt af van meer urgente bedreigingen voor het milieu, experts waarschuwen
Oorlog tegen plastic leidt af van meer urgente bedreigingen voor het milieu, experts waarschuwen Mammoetveld wakkert Noorse olie-industrie aan
Mammoetveld wakkert Noorse olie-industrie aan Verouderde attitudes dreigen de ongelijkheden op hybride werkplekken te vergroten, denktank waarschuwt
Verouderde attitudes dreigen de ongelijkheden op hybride werkplekken te vergroten, denktank waarschuwt 78, Grottenrecord van 000 jaar uit Oost-Afrika toont vroege culturele innovaties
78, Grottenrecord van 000 jaar uit Oost-Afrika toont vroege culturele innovaties In kaart brengen en meten van eiwitten op de oppervlakken van endoplasmatisch reticulum (ER) in cellen
In kaart brengen en meten van eiwitten op de oppervlakken van endoplasmatisch reticulum (ER) in cellen Diep lerend neuraal netwerk dat wordt gebruikt om aardbevingen te detecteren
Diep lerend neuraal netwerk dat wordt gebruikt om aardbevingen te detecteren raar leven
raar leven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

