
Wetenschap
Orde van wanorde in de sarcomeer
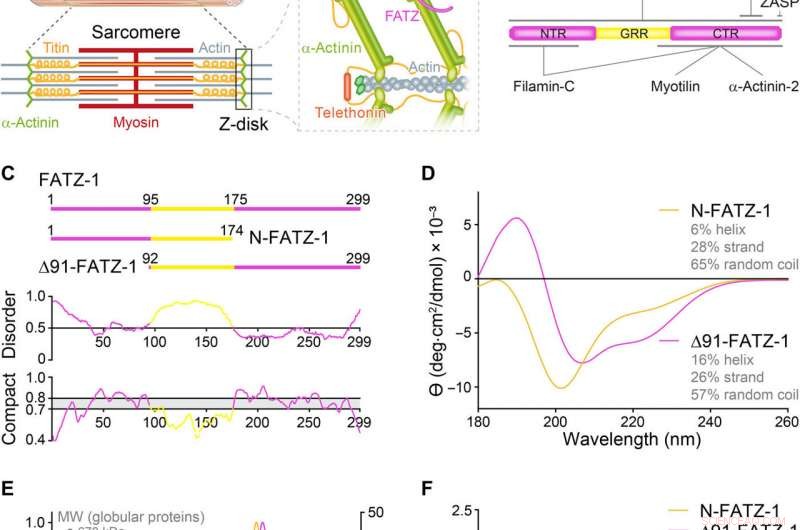
Eiwitten van de FATZ-familie vertonen intrinsieke wanorde. (A) Schema's van het dwarsgestreepte spiersarcomeer en close-up van F-actine/α-actinine/FATZ-interacties in Z-schijf. (B) Schema's van het FATZ-1-interactoom en bindingsplaatsen die tot nu toe zijn gerapporteerd. (C) Schema's van de belangrijkste FATZ-1-constructies, samen met hun aminozuurgrenzen en domeinsamenstelling. Voorspelde wanordelijke regio's (boven 0,5) en compactheid (boven 0,8) worden hieronder weergegeven. (D) circulair dichroïsme (CD) spectra van N-FATZ-1 en Δ91-FATZ-1, samen met de berekende inhoud van de secundaire structuur. (E) Grootte-uitsluitingschromatografie (SEC)-multiangle lichtverstrooiing (MALS) analyse van N-FATZ-1 en Δ91-FATZ-1, met molecuulgewichten (MW's) van 21 en 24 kDa, respectievelijk. De elutievolumes waren lager dan verwacht in vergelijking met globulaire standaarden [thyroglobuline (670 kDa), γ-globuline (158 kDa), ovalbumine (44 kDa), en myoglobine (17 kDa)], overeenkomend met MW's van 50 en 46 kDa voor N-FATZ-1 en Δ91-FATZ-1, respectievelijk. UV, ultraviolet. (F) Dimensieloze Kratky-plots van N-FATZ-1 en Δ91-FATZ-1, evenals van bolvormig runderserumalbumine (BSA) (SASBDB-code SASDFQ8). Experimentele SEC-kleine-hoek röntgenverstrooiing (SAXS) gegevens van N-FATZ-1 (G) en Δ91-FATZ-1 (I) en corresponderende pasvorm voor de gegevens van geselecteerde ensembles verkregen met Ensemble Optimization Method (EOM). Rg-verdelingen van geselecteerde ensembles ten opzichte van de verdeling van een willekeurige pool worden weergegeven in de inzetstukken. Modelvertegenwoordigers van de geselecteerde EOM-ensembles voor N-FATZ-1 (H) en Δ91-FATZ-1 (J), samen met hun Rg (in nanometers) en volumefracties (in procenten). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abg7653
Alfa-actinine kan actinefilamenten verknopen en verankeren aan de Z-schijf in sarcomeren. Sarcomeren zijn een structurele eenheid van myofibril in dwarsgestreepte spieren. De FATZ (film, α-actinine- en telethonine-bindend eiwit van het Z-disk) eiwit kan interageren met α-actinine en andere kern Z-schijf eiwitten die bijdragen aan de assemblage en het onderhoud van myofibrillen. In een nieuw verslag nu op wetenschappelijke vooruitgang , Antonio Sponga en een internationaal onderzoeksteam in Oostenrijk, Duitsland, Rusland, Polen en het VK hebben de eerste structuur en cellulaire validatie van het α-actinine-2-complex beschreven met een Z-schijfpartner, FATZ-1, om een conformistisch ensemble te vormen. De FATZ-1 vormde een strak fuzzy complex met α-actinine-2 met een voorgesteld interactiemechanisme via moleculaire herkenningselementen en secundaire bindingsplaatsen. Het verkregen integratiemodel onthulde een polaire architectuur van het complex in combinatie met de FATZ-1 multivalente scaffoldfunctie om interactiepartners te organiseren en te stabiliseren.
Sarcomeer
De samentrekkende spieren kunnen vrijwillige bewegingen van dieren en onwillekeurige hartslag reguleren, en sarcomeren zijn de basiscontractiele eenheden van dwarsgestreepte spiercellen. Ze zijn samengesteld uit reeksen dunne (actine) en dikke (myosine) filamenten die tijdens contractie langs elkaar glijden. De Z-schijf kan de grens vormen tussen aangrenzende sarcomeren, waar antiparallelle actinefilamenten zijn verankerd. Een geschikte stabiele verankeringsstructuur moet worden gegenereerd door de interactie tussen myosine en actine. De Z-schijf kan deze rol vervullen door te fungeren als een mechanische hub en een signaalplatform om de overdracht van spanning tijdens contractie en de duur en overdracht van informatie over biomechanische stress mogelijk te maken. Als resultaat, elke mutatie die de architectuur en functie van de Z-schijf verstoort, kan het risico op skelet- en hartdisfunctie veroorzaken.
Het eiwitcomplex
Alfa-actinine is een F-actine-verknopend eiwit in Z-schijven van spieren, die een belangrijke Z-schijfcomponent vormt die antiparallelle actinefilamenten van aangrenzende sarcomeren vernet om te dienen als een bindingsplatform voor meerdere Z-schijfeiwitten, inclusief FATZ-1. De FATZ-eiwitten kunnen binden aan α-actinine via hun c-terminale regio en aan domeinen van de Enigma-familieleden via een specifiek c-terminaal herkenningsmotief. In dit werk, Antonio Sponga et al. toonde aan hoe FATZ-eiwitten intrinsiek ongeordende regio's (IDR's) bevatten, het best te omschrijven als een conformationeel ensemble, die minder stabiel zijn en geen stabiele tertiaire structuur hebben. Naast biofysische karakteriseringsmethoden, het team gebruikte röntgenkristallografie en kleine-hoek röntgenverstrooiing om een "fuzzy" α-actinine-2 / FATZ-1-complex te beschrijven. Het FATZ-1-eiwit kan een organisatorische rol spelen in de Z-schijf vanwege zijn multivalente steigereigenschappen en een strak complex van polaire architectuur vormen met α-actinine-2.
FATZ-1 vormt een strak 2:1-complex met α-actinine-2-dimeer via meerdere bindingsplaatsen. (A) Schema's van de α-actinine-2-constructen, samen met hun aminozuurgrenzen en domeinsamenstelling. SEC-MALS-analyse voor de interactie van FATZ-1, FATZ-2, en FATZ-3 met α-actinine-2 (B), N-FATZ-1 met staaf-α-actinine-2 (C), Δ91-FATZ-1 met hd-α-actinine-2 (D), en fiveE A91-FATZ-1-mutant met α-actinine-2 (E). ITC-analyse voor de interactie van Δ91-FATZ-1 met α-actinine-2 (F), N-FATZ-1 met staaf-α-actinine-2 (G), Δ91-FATZ-1 met hd-α-actinine-2 (H), en fiveE A91-FATZ-1-mutant met α-actinine-2 (I). z.g., niet bepaald. (J) 1H-15N HSQC-signaalintensiteitsverhouding van 15N Δ91-FATZ-1 gebonden/vrij, het in kaart brengen van de primaire bindingsplaats van FATZ-1 voor α-actinine-2. Niet-toegewezen deel in FATZ-1 is verpakt, en residuen worden op een willekeurige positie uitgezet. (K) Sequentie van FATZ-1 die meerdere interactieplaatsen voor α-actinine-2 laat zien, zoals bepaald uit de peptide-array (gekwadrateerde residuen), XL-MS (ster), LP-MS (residuen begrensd door pijlen), en NMR (pijlen). Residuen die overeenkomen met het sterkste signaalpeptide in de peptide-array zijn vetgedrukt weergegeven. Grenzen voor Δ91-FATZ-1 en mini-FATZ-1 worden afgebakend door pijlen. Mutaties binnen vijfE Δ91-FATZ-1 en RRE Δ91-FATZ-1 zijn aangegeven in oranje en donkercyaan, respectievelijk. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abg7653 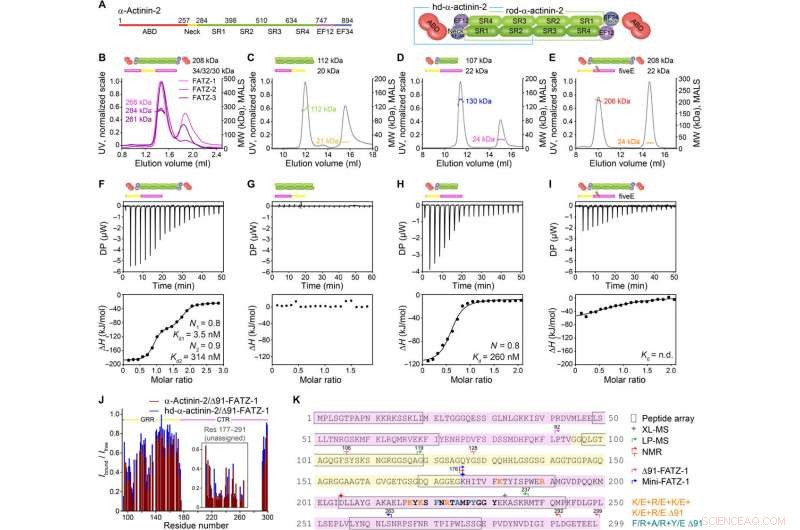
De FATZ-eiwitfamilie wordt aangetroffen in alle gewervelde dieren waar menselijke FATZ-1, FATZ-2, en FATZ-3 delen 34 tot 40 procent sequentie-identiteit. De wetenschappers herkenden proteolyse-resistente fragmenten, na het uitvoeren van proteolyse-experimenten. Toen ze grootte-uitsluitingschromatografie (SEC) combineerden met lichtverstrooiing met meerdere hoeken, ze merkten de overheersende monomeren op onder experimentele omstandigheden. Vervolgens karakteriseerden ze de monomeren verder met behulp van SEC in combinatie met röntgenverstrooiing met een kleine hoek en benadrukten ze ook de intrinsiek ongeordende / ensemble-toestand van de monomeren met behulp van spectra met één kwantumcoherentie (HSQC), voor beide constructies. Om de bindingsstoichiometrie van de FATZ-1-naar-3-eiwitten aan α-actinine-2 te begrijpen, Sponga et al. gebruikte grootte-uitsluitingschromatografie-multiangle lichtverstrooiing (SEC-MALS). Om de bindingsstoichiometrie van de FATZ-1-naar-3-eiwitten aan α-actinine-2 te karakteriseren, Sponga et al. gebruikte SEC-MALS. De uitkomst toonde aan hoe elk van de drie FATZ-eiwitten een strak complex vormde met α-actinine-2, met een bindende stoichiometrie van twee FATZ-moleculen per α-actinine-2-dimeer. Dat is één FATZ-molecuul per α-actinine-2-subeenheid. Het team gebruikte vervolgens isothermische titratiecalorimetrie (ITC) om de interactieaffiniteit te kwantificeren.
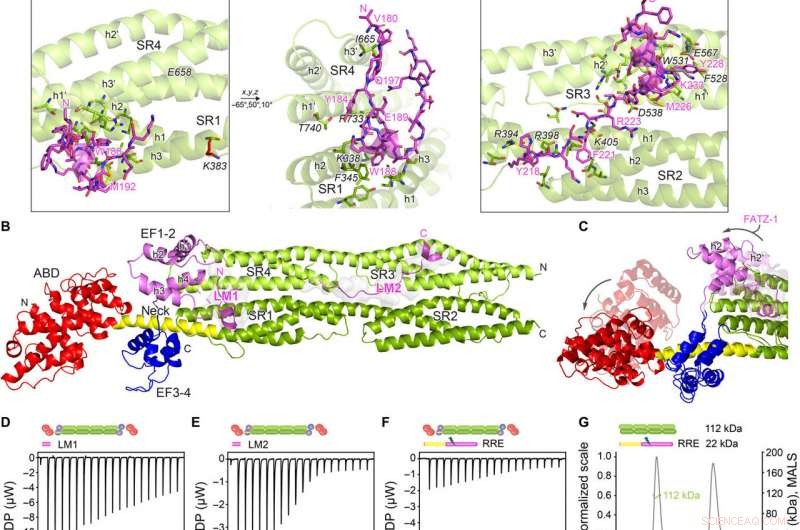
Kristalstructuren van α-actinine-2 / FATZ-1 onthullen twee lineaire bindingsmotieven in FATZ-1. (A) Kristalstructuur van staaf-α-actinine-2/mini-FATZ-1 (in groen/magenta), samen met de bepaalde FATZ-1-consensussequentie (35 tot 80% en 60 tot 84% paarsgewijze sequentie-identiteit voor LM1 en LM2, respectievelijk). Verknoopte resten zijn aangegeven met blauw, rood, en grijze sterren/ballen/stokjes op de reeks/structuur. Geïdentificeerde Se-Mets worden in geel weergegeven. Het staaf-α-actinine-2-dimeer wordt geassembleerd via een kristallografische tweevoudige as tussen symmetriepartners (zwarte cirkel). Interagerende residuen (staaf-α-actinine-2 in cursief), samen met helices van SR1/SR2 (h1, h2, en h3) en SR3/SR4 (h1′, h2′, en h3′), worden weergegeven in close-upweergaven. (B) Kristalstructuur van hd-α-actinine-2 / Δ91-FATZ-1 (LM1 en LM2 als magenta cartoon en transparant grijs oppervlak; hd-α-actinine-2 kleurgecodeerd zoals in Fig. 2A). (C) Vergelijking van ongebonden [Protein Data Bank (PDB) code 4D1E] en gebonden (dit werk) hd-α-actinine-2. ABD en EF1-2 van ongebonden hd-α-actinine-2 worden transparant weergegeven. ITC-analyse voor de interactie van LM1-peptide met α-actinine-2 (D), LM2-peptide met α-actinine-2 (E), en RRE A91-FATZ-1-mutant met α-actinine-2 (F). SEC-MALS-analyse voor de interactie van RRE Δ91-FATZ-1-mutant met rod-α-actinine-2 (G) en Δ91-FATZ-1 met E. histolytica rod-α-actinine-2 (H). Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abg7653
Meerdere bindingsplaatsen voor het eiwitcomplex
Het team merkte op hoe FATZ-1 via meerdere bindingsplaatsen interageerde met α-actinine-2. Om de FATZ-1-bindingsplaatsen te beperken, Sponga et al. gebruikte beperkte proteolyse en chemische verknoping gekoppeld aan massaspectrometrie op het eiwitcomplex. Om vervolgens de kristallisatie van dit eiwitcomplex te bevorderen, het team combineerde vervolgens ook de informatie van de peptide-array en genereerde een kortere constructie die bekend staat als mini-FATZ-1 voor verder onderzoek naar hun structurele biologie. De wetenschappers valideerden vervolgens de vage modellen die in het werk waren ontwikkeld met behulp van berekende en experimenteel afgeleide intrinsieke viscositeit - een hydrodynamische parameter van eiwitconformatie. Om vervolgens de bijdrage van α-actinine-2 aan het lokaliseren van FATZ-eiwitten op de Z-schijf van het sarcomeer te begrijpen, Sponga et al. getransfecteerde GFP-gelabelde FATZ-1- of FATZ-2-eiwitten in onsterfelijk gemaakte muismyoblasten of neonatale rattencardiomyocyten. Zowel FATZ-1- als -2-eiwitten waren correct gericht op de Z-schijf en co-gelokaliseerd met α-actinine-2.
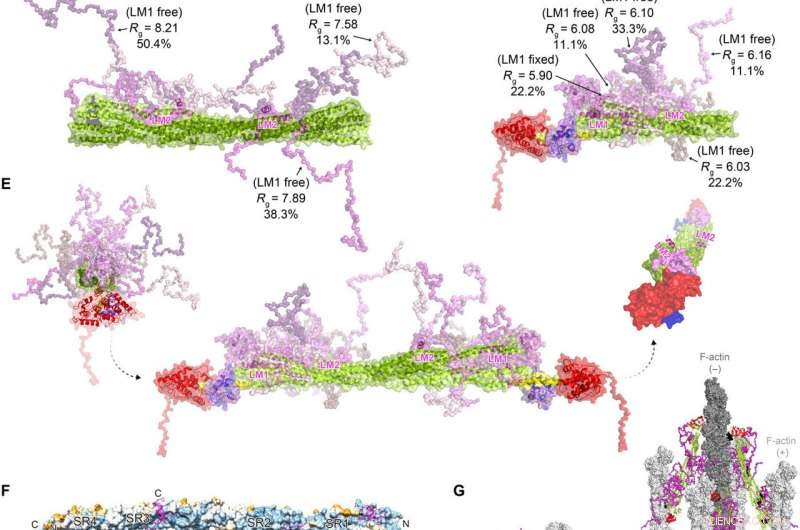
FATZ-1 vormt een vaag complex met α-actinine-2, wat resulteert in een polaire architectuur van het complex. Experimentele SAXS-gegevens van rod-α-actinine-2/Δ91-FATZ-1 (A) en hd-α-actinine-2/Δ91-FATZ-1 (B), met het bijbehorende model past bij de gegevens van de geselecteerde ensembles. GAJOE, Genetisch algoritme dat optimalisatie van ensembles beoordeelt. Flexibele regio's van Δ91-FATZ-1, niet zichtbaar in onze bepaalde kristalstructuren, werden gegenereerd met EOM waarbij LM1 vast of gratis bleef (10, 000 modellen voor elk). Geselecteerde ensemblemodelvertegenwoordigers voor rod-α-actinine-2/Δ91-FATZ-1 (C) en hd-α-actinine-2/Δ91-FATZ-1 (D), samen met hun Rg- en volumefracties binnen het ensemble. (E) Integratief model van fuzzy α-actinine-2/Δ91-FATZ-1 gebouwd met behulp van röntgenkristallografie en SAXS-modellen van hd-α-actinine-2/Δ91-FATZ-1. Rotatie voor LM2-helices van gebonden FATZ-1-moleculen ten opzichte van elkaar, evenals torsiedraaiing in de staaf langs de longitudinale α-actinine-2-as, wordt weergegeven in de rechter inzet (FATZ-1 flexibele onderdelen zijn voor de duidelijkheid weggelaten). (F) Oppervlak van de staaf-α-actinine-2 / FATZ-1-structuur die de sequentieconservering van α-actinine-interagerende residuen voor FATZ-1 toont (uitlijning gedaan met 1505 α-actinines van gewervelde dieren). (G) Model van F-actine / α-actinine-2 / FATZ-1 (F-actine in licht- en donkergrijs) op basis van een cryo-elektronentomografiestructuur van de Z-schijf en het integratieve model. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abg7653
Outlook
Op deze manier, Antonio Sponga en collega's beschreven hoe de sarcomeerassemblage begon met Z-lichamen van α-actinine-2, om eiwitten zoals FATZ, myotiline, en actine, om er een paar te noemen. De uitkomst geeft aan dat eiwitten van de FATZ-familie beschikbaar zijn in Z-lichamen en volwassen Z-schijven met een rol in eiwitsignaleringsroutes om calcineurine te binden. Het team benadrukte de rol van FATZ-1, het meest bestudeerde familielid en zijn interactie met het belangrijkste Z-schijfeiwit α-actinine-2. De structuur en het bindingsmechanisme van het fuzzy -actinine-2 / FATZ-1-complex ondersteunde FATZ-1-functie als een klassiek steigereiwit in de Z-schijfassemblage. Nader onderzoek zal uitwijzen of dezelfde principes ook gelden onder fysiologische omstandigheden in levende cellen.
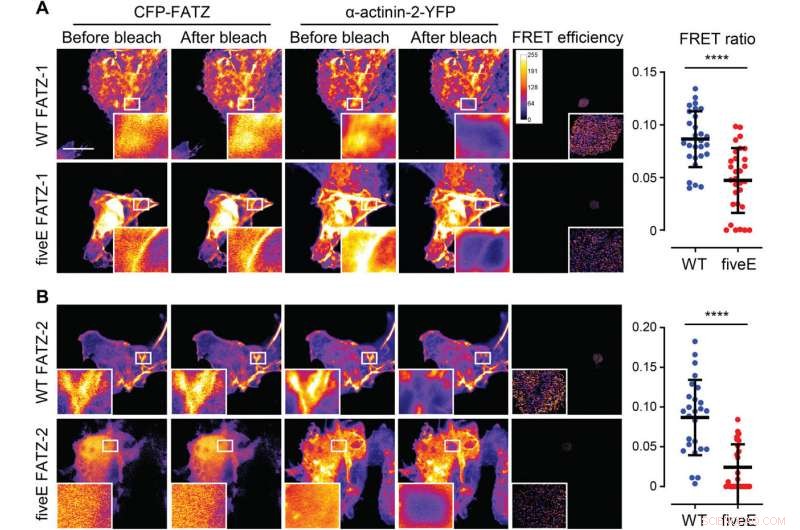
α-Actinine-2 stabiliseert FATZ-eiwitten op de Z-schijf. (A) COS-1-cellen die verbeterde CFP (ECFP)-gelabelde FATZ-1 (WT FATZ-1) of overeenkomstige fiveE-mutant tot co-expressie brengen, in combinatie met actinine-2-EYFP, zoals bepaald in gefixeerde cellen door middel van acceptorfotobleken. Representatieve afbeeldingen worden getoond voor en na het bleken voor beide eiwitten. Gebleekte interessegebieden worden getoond (inzetstukken), samen met FRET-efficiënties die worden gebruikt om FRET-verhoudingen te berekenen die worden weergegeven in de aangrenzende grafiek [n =28 (WT) en 30 (vijfE), ****P <0,0005, t-toets van de student). (B) Dezelfde cellen als in (A) maar met ECFP-gelabelde FATZ-2-varianten in combinatie met EYFP-α-actinine-2 [n =26 (WT) en 25 (fiveE), ****P <0,0005, t-toets van de student). Schaalbalken, 10 m in alle afbeeldingen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.abg7653
© 2021 Science X Network
 Sterk en kneedbaar Damascus-staal door additieve fabricage
Sterk en kneedbaar Damascus-staal door additieve fabricage Van broeikasgassen tot plastic:nieuwe katalysator voor recycling koolstofdioxide ontdekt
Van broeikasgassen tot plastic:nieuwe katalysator voor recycling koolstofdioxide ontdekt Hoe maak je een Perpetual Motion Water drinken Toy Bird
Hoe maak je een Perpetual Motion Water drinken Toy Bird  Hoe een oplossingsset op te lossen & te plotten
Hoe een oplossingsset op te lossen & te plotten  Op zoek naar perfecte chemie - een visie voor verenigende katalyse
Op zoek naar perfecte chemie - een visie voor verenigende katalyse
 Langdurige studie toont aan dat atmosferische bioom fluctueert per seizoen
Langdurige studie toont aan dat atmosferische bioom fluctueert per seizoen Vijf miljoen jaar klimaatverandering bewaard op één plek
Vijf miljoen jaar klimaatverandering bewaard op één plek Evacuaties breiden zich uit in Oregon terwijl vuur zich grillig verspreidt
Evacuaties breiden zich uit in Oregon terwijl vuur zich grillig verspreidt Onderzoekers stellen klimaatslimme woestijnvoedselproductiemodel voor land en menselijke gezondheid voor
Onderzoekers stellen klimaatslimme woestijnvoedselproductiemodel voor land en menselijke gezondheid voor Radar onthult smeltwater het hele jaar door leven onder Groenlands ijs
Radar onthult smeltwater het hele jaar door leven onder Groenlands ijs
Hoofdlijnen
- Evolutie:de begunstigden van massale uitsterving
- Roofzuchtige bacteriën - de zoektocht naar een nieuwe klasse antibiotica
- Wat gebeurt er als er geen zuurstof beschikbaar is aan het einde van langzame glycolyse?
- Typen cellijnen
- Kleine Braziliaanse kikkers zijn doof voor hun eigen roep
- Is de remedie tegen kanker een virus?
- Wetenschappers voltooien conserveringspuzzel, begrip van het leven op aarde vormen
- Waarom mensen schreeuwen,
- Uitleg van celspecialisatie
- Studie legt basis voor toekomstig medicijnontwerp

- Hoe valentie van elektronen in het periodiek systeem te berekenen

- Wetenschappers demonstreren hoe staaleigenschappen kunnen worden verbeterd

- Wetenschappers stellen IAP-proces voor voor scheiding van aluminiumlegeringen
- Langzame opwekking van lading speelt grote rol in modelmateriaal voor zonnecellen
 Model om beter te voorspellen hoe klimaatverandering het elektriciteitsverbruik van Amerikanen in de zomer zal beïnvloeden
Model om beter te voorspellen hoe klimaatverandering het elektriciteitsverbruik van Amerikanen in de zomer zal beïnvloeden Vroege gegevens wijzen op bruisende Amerikaanse vakantieverkopen
Vroege gegevens wijzen op bruisende Amerikaanse vakantieverkopen Instandhoudingsdoelen concurreren ten koste van biodiversiteit
Instandhoudingsdoelen concurreren ten koste van biodiversiteit Telescoopontwerp belooft een revolutie teweeg te brengen in de amateurastronomie
Telescoopontwerp belooft een revolutie teweeg te brengen in de amateurastronomie Onderzoekers vinden nieuwe manier om licht te regelen met elektrische velden
Onderzoekers vinden nieuwe manier om licht te regelen met elektrische velden Wat zijn de voor- en nadelen van langere zonnecontracten?
Wat zijn de voor- en nadelen van langere zonnecontracten? Nieuwe fase van globalisering kan inspanningen om CO2-uitstoot te verminderen ondermijnen
Nieuwe fase van globalisering kan inspanningen om CO2-uitstoot te verminderen ondermijnen Xerox beëindigt fusie met Fujifilm in overwinning voor aandeelhouders
Xerox beëindigt fusie met Fujifilm in overwinning voor aandeelhouders
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

