
Wetenschap
In een veld waar kleiner beter is, onderzoekers ontdekken 's werelds kleinste antistoffen
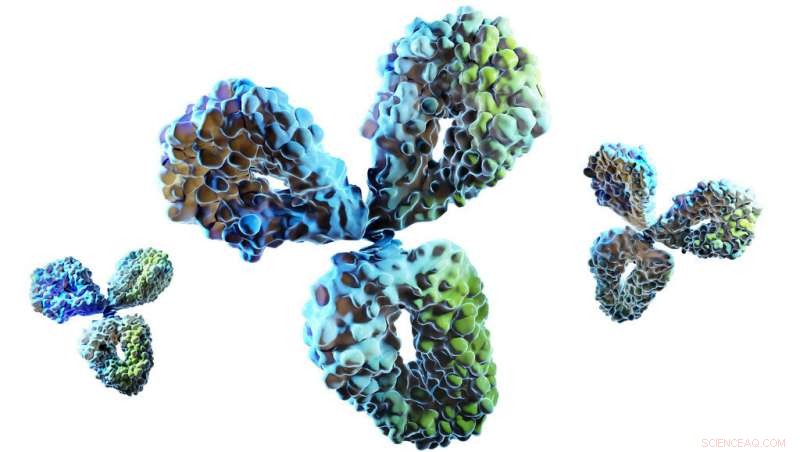
Volledige structuur van een antilichaam, zijn domeinen tonen. Krediet:Universiteit van Bath
Onderzoekers van de Universiteit van Bath in het VK en biofarmaceutisch bedrijf UCB hebben een manier gevonden om geminiaturiseerde antilichamen te produceren, de weg vrijmaken voor een potentiële nieuwe klasse van behandelingen voor ziekten.
Tot nu, de kleinste door de mens gemaakte antilichamen (bekend als monoklonale antilichamen, of mAbs) zijn afgeleid van lama's, alpaca's en haaien, maar de doorbraakmoleculen die worden geïsoleerd uit de immuuncellen van koeien zijn tot vijf keer kleiner. Dit is te danken aan een ongebruikelijk kenmerk van een runderantilichaam dat bekend staat als een knopdomein.
De potentiële medische implicaties van de kleine omvang van de nieuwe antilichamen zijn enorm. Bijvoorbeeld, ze kunnen binden aan plaatsen op pathogenen waar reguliere antilichaammoleculen te groot zijn om zich aan vast te klampen, het veroorzaken van de vernietiging van invasieve microben. Ze kunnen mogelijk ook toegang krijgen tot plaatsen van het lichaam die grotere antilichamen niet kunnen.
Antilichamen bestaan uit ketens van aminozuren (de bouwstenen van eiwitten) die samenkomen in een lusvormige structuur. De lussen in de kettingen, bekend als complementariteitsbepalende regio's, binden aan antigeendoelen, waardoor het immuunsysteem wordt geactiveerd. Runderantilichamen zijn lusiger dan de meeste, en ongeveer 10% bevat een knopdomein - een kenmerk dat uniek is bij gewervelde kaken. Deze dicht opeengepakte bundels mini-loops worden gepresenteerd op een eiwitstengel, ver van andere lussen, en worden verondersteld een cruciale rol te spelen bij het binden.
De reden waarom knopdomeinen voor opschudding zorgen, is eenvoudig:geïsoleerd van de rest van het antilichaam, deze lusuitbreidingen kunnen autonoom functioneren, effectief kleine antilichamen maken die stevig aan hun doelen kunnen binden.
Professor Jean van den Elsen van de afdeling Biologie en Biochemie van Bath, die bij het onderzoek betrokken was, zei dat deze bevinding verrassend was. "Deze knoppen zijn in staat om hun doelwit te binden als complete antilichamen, dus in feite zijn we voor het eerst in staat geweest om antilichamen te miniaturiseren."
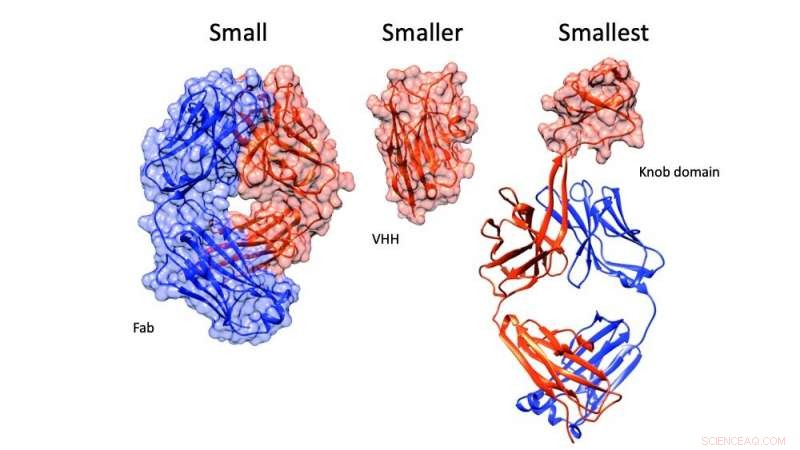
Van links naar rechts:het antigeenbindende fragment van een antilichaam (Fab), een antilichaamfragment dat bestaat uit een antilichaam met een enkel domein (VHH) en een knopdomein. Krediet:PLOS Biologie en Alex Macpherson
Deze nieuwe moleculen zijn ontwikkeld als onderdeel van een samenwerkingsproject tussen de Universiteit van Bath en het wereldwijde biofarmaceutische bedrijf UCB. Ze zijn afkomstig van koeien die zijn geïmmuniseerd door injectie met een antigeen (deeltjes van een vreemd lichaam), een immuunrespons uitlokken. Natuurlijke antistoffen worden gewonnen uit de koe, door een proces van sorteren en 'deep sequencing' van antilichaamproducerende B-cellen. De resulterende antilichamen worden vervolgens in het laboratorium vervaardigd in culturen van menselijke cellen.
Regelmatige antilichamen worden door het menselijk lichaam gemaakt als onderdeel van zijn natuurlijke reactie op een infectie, terwijl monoklonale antilichamen aan een patiënt worden toegediend wanneer een infectie zich heeft voorgedaan en ze moeite hebben om deze zonder hulp te verslaan. In de laatste paar decennia, mAbs zijn naar voren gekomen als effectieve behandelingen voor verschillende medische aandoeningen, inclusief kanker, auto-immuunziekten en ernstige virale infecties. Het is te hopen dat geminiaturiseerde mAbs uiteindelijk zullen worden betrokken bij een reeks medicamenteuze therapieën.
Het antigeen dat door de Bath-onderzoekers wordt gebruikt om bij koeien een immuunrespons op te wekken, wordt complementcomponent C5 genoemd, en C5 speelt een rol bij veel menselijke ziekten (waaronder COVID-19), waar een ontstekingsreactie is.
Deze nieuwe monoklonale antilichamen hebben niet alleen een voordeel in grootte ten opzichte van reguliere mAb's, maar ze zijn ook robuuster, wat betekent dat ze langer stabiel blijven.
"Ze hebben zeer stevige, dicht opeengepakte structuren, "zei professor van den Elsen. "Dus ze komen niet alleen beter op plaatsen dan andere antistoffen, maar ze kunnen ook veel langer houdbaar zijn."
Alex Macpherson, een doctoraat student aan Bath en biochemicus aan UCB, wie is de hoofdauteur van het papier, toegevoegd:"De ontdekking van antilichaamgeneesmiddelen is een gevestigd veld, maar dit onderzoek opent geheel nieuwe mogelijkheden. Er is een enorm potentieel gebruik voor deze geminiaturiseerde antilichamen."
Alastair Lawson, Immunology Fellow bij UCB en UCB hoofd van het project zei:"Dit onderzoek heeft geleid tot de ontdekking van de kleinste klinisch relevante antilichaamfragmenten die ooit zijn gerapporteerd en we zijn erg enthousiast over hun potentieel."
 Onderzoekers rapporteren over celdoorlatende nanobodies
Onderzoekers rapporteren over celdoorlatende nanobodies Recombinant collageenpolypeptide als een veelzijdig biomateriaal voor bottransplantaten
Recombinant collageenpolypeptide als een veelzijdig biomateriaal voor bottransplantaten Een nieuw type chemische binding:de ladingsverschuivingsbinding
Een nieuw type chemische binding:de ladingsverschuivingsbinding Waar vindt chemische vertering plaats?
Waar vindt chemische vertering plaats?  Energie uit zeewater:stroomgenerator schakelt autonoom tussen twee functionele modi
Energie uit zeewater:stroomgenerator schakelt autonoom tussen twee functionele modi
 Welke effecten heeft kauwgom op het milieu?
Welke effecten heeft kauwgom op het milieu?  Lavaverspreiding doet vrezen voor meer schade op Spaans eiland
Lavaverspreiding doet vrezen voor meer schade op Spaans eiland Zonlicht en de juiste microben zetten Arctische koolstof om in koolstofdioxide
Zonlicht en de juiste microben zetten Arctische koolstof om in koolstofdioxide Klimaatslachtoffers zoeken gerechtigheid, op straat en in de rechtszaal
Klimaatslachtoffers zoeken gerechtigheid, op straat en in de rechtszaal Aarde, wind, flora zwaait Trinidad zwavelgehaltes
Aarde, wind, flora zwaait Trinidad zwavelgehaltes
Hoofdlijnen
- Genetische barcodes worden gebruikt om cruciale populaties in een ecosysteem van koraalriffen te kwantificeren
- Ondanks de wet stijgt het aantal doden door loodvergiftiging in New Hampshire
- Onderzoek suggereert vrouwelijk voordeel in levensverwachting gerelateerd aan fundamentele biologische wortels
- Hoe wordt ureum gemaakt?
- Studie identificeert walvisblaasmicrobioom
- Lijst van de toepassingen van elektroforese
- Individuele genomen van patiënten kunnen de werkzaamheid beïnvloeden, veiligheid van het bewerken van genen
- Wat is het doel van de promotor en terminatorregio van de DNA-molecule?
- Wat zijn stamcellen en waarvoor worden ze gebruikt?
- Wetenschappers ontwikkelen nieuwe aanpak om te voorspellen hoe vloeistoffen bevriezen

- Wetenschappers maken nieuw bouwmateriaal van schimmel, rijst en glas

- Nieuwe studie verklaart de creatie van gels die pesticiden en andere stoffen op een gecontroleerde manier afgeven

- Ons DNA wordt 's werelds kleinste harde schijf
- Onderzoekers creëren een 3D-geprinte slimme gel die onder water loopt, beweegt objecten

 Veiliger naderen van luchthavens met 3D-satellietnavigatie
Veiliger naderen van luchthavens met 3D-satellietnavigatie Hoe ml omzetten in Ounces
Hoe ml omzetten in Ounces Als het zee-ijs smelt, juveniele poolkabeljauw kan honger lijden
Als het zee-ijs smelt, juveniele poolkabeljauw kan honger lijden Nanopore-techniek decodeert snel lange DNA-strengen
Nanopore-techniek decodeert snel lange DNA-strengen Silicium microdeeltjes, gadonanotubes beloven grote vooruitgang voor medische beeldvorming
Silicium microdeeltjes, gadonanotubes beloven grote vooruitgang voor medische beeldvorming Astronaut en moonwalker Alan Bean sterft op 86-jarige leeftijd
Astronaut en moonwalker Alan Bean sterft op 86-jarige leeftijd Cloudsat neemt een plak van tropische storm Isaias
Cloudsat neemt een plak van tropische storm Isaias Transparante coatings voor alledaagse toepassingen
Transparante coatings voor alledaagse toepassingen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | German | Dutch | Danish | Norway | Swedish |

-
Wetenschap © https://nl.scienceaq.com

