
Wetenschap
Herontworpen enzym kan schade door ruggenmergletsel en beroerte helpen terugdraaien
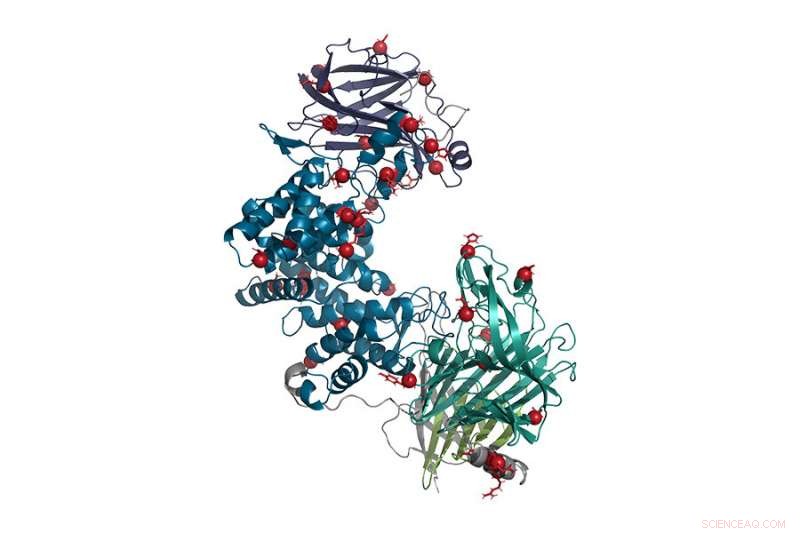
In deze weergave van het enzym chondroïtinase ABC, puntmutaties worden weergegeven door rode ballen. Deze opnieuw ontworpen vorm van het enzym is stabieler en actiever dan het wilde type en kan worden gebruikt om zenuwbeschadiging veroorzaakt door ruggenmergletsel of beroerte te helpen herstellen. Krediet:Hettiaratchi, O'Meara et al., 2020. DOI:10.1126/sciadv.abc6378 Dit werk is gelicentieerd onder CC BY-NC
Een team van onderzoekers van University of Toronto Engineering en de University of Michigan heeft een natuurlijk enzym opnieuw ontworpen en verbeterd dat veelbelovend is bij het bevorderen van de hergroei van zenuwweefsel na een blessure.
Hun nieuwe versie is stabieler dan het eiwit dat in de natuur voorkomt, en kan leiden tot nieuwe behandelingen voor het omkeren van zenuwbeschadiging veroorzaakt door traumatisch letsel of beroerte.
"Beroerte is de belangrijkste oorzaak van invaliditeit in Canada en de derde belangrijkste doodsoorzaak, ", zegt Molly Shoichet, professor Engineering aan de Universiteit van Toronto, senior auteur van een nieuwe studie gepubliceerd in het tijdschrift wetenschappelijke vooruitgang .
"Een van de grootste uitdagingen voor genezing na dit soort zenuwbeschadiging is de vorming van een gliaal litteken."
Een gliaal litteken wordt gevormd door cellen en biochemicaliën die zich stevig rond de beschadigde zenuw hechten. Op korte termijn, deze beschermende omgeving beschermt de zenuwcellen tegen verder letsel, maar op de lange termijn kan het zenuwherstel remmen.
Ongeveer twee decennia geleden, wetenschappers ontdekten dat een natuurlijk enzym dat bekend staat als chondroïtinase ABC - geproduceerd door een bacterie genaamd Proteus vulgaris - selectief enkele van de biomoleculen waaruit het gliale litteken bestaat, kan afbreken.
Door de omgeving rond de beschadigde zenuw te veranderen, Van chondroïtinase ABC is aangetoond dat het de hergroei van zenuwcellen bevordert. In diermodellen is het kan zelfs leiden tot het herwinnen van een verloren functie.
Maar de vooruitgang werd beperkt door het feit dat chondroïtinase ABC niet erg stabiel is op de plaatsen waar onderzoekers het willen gebruiken.
"Het is stabiel genoeg voor de omgeving waarin de bacteriën leven, maar in het lichaam is het erg kwetsbaar, " zegt Shoichet. "Het aggregeert, of samenklontert, waardoor het activiteit verliest. Dit gebeurt sneller bij lichaamstemperatuur dan bij kamertemperatuur. Het is ook moeilijk om chondroïtinase ABC af te leveren omdat het gevoelig is voor chemische afbraak en afschuifkrachten die typisch in formuleringen worden gebruikt."
Diverse ploegen, inclusief Shoichet's, hebben geëxperimenteerd met technieken om deze instabiliteit te overwinnen. Sommigen hebben geprobeerd het enzym in biocompatibele polymeren te wikkelen of het aan nanodeeltjes te hechten om te voorkomen dat het aggregeert. Anderen hebben geprobeerd het langzaam en geleidelijk in beschadigd weefsel te injecteren, om een consistente concentratie op de plaats van de verwonding te verzekeren.
Maar al deze benaderingen zijn slechts pleisters - ze pakken het fundamentele probleem van instabiliteit niet aan.
In hun laatste krant Shoichet en haar medewerkers probeerden een nieuwe aanpak:ze veranderden de biochemische structuur van het enzym om een stabielere versie te creëren.
"Zoals elk eiwit, chondroïtinase ABC bestaat uit bouwstenen die aminozuren worden genoemd, ", zegt Shoichet. "We gebruikten computationele chemie om het effect te voorspellen van het verwisselen van sommige bouwstenen voor andere, met als doel de algehele stabiliteit te vergroten terwijl de activiteit van het enzym behouden of verbeterd wordt."
"Het idee was waarschijnlijk een beetje gek, want net als in de natuur, een enkele slechte mutatie kan de structuur vernielen, " zegt Mathew O'Meara, een professor in computationele geneeskunde en bio-informatica aan de Universiteit van Michigan, en co-lead auteur van het nieuwe artikel.
"Er zijn meer dan 1 000 schakels in de keten die dit enzym vormt, en voor elke link heb je 20 aminozuren om uit te kiezen, "zegt hij. "Er zijn te veel keuzes om ze allemaal te simuleren."
Om de zoekruimte te verkleinen, het team paste computeralgoritmen toe die de soorten aminozuursubstituties nabootsten die in echte organismen worden aangetroffen. Deze benadering - bekend als consensusontwerp - produceert mutante vormen van het enzym die in de natuur niet voorkomen, maar zijn aannemelijk zoals degenen die dat wel doen.
Uiteindelijk, het team eindigde met drie nieuwe kandidaat-vormen van het enzym die vervolgens in het laboratorium werden geproduceerd en getest. Alle drie waren stabieler dan het wildtype, maar slechts één, die 37 aminozuursubstituties had van meer dan 1, 000 schakels in de keten, was zowel stabieler als actiever.
"Het wildtype chondroïtinase ABC verliest het grootste deel van zijn activiteit binnen 24 uur, terwijl ons opnieuw ontworpen enzym zeven dagen actief is, " zegt Marian Hettiaratchi, de andere co-hoofdauteur van het artikel. Een voormalig postdoctoraal fellow in Shoichet's lab, Hettiaratchi is nu hoogleraar bio-engineering aan de Phil and Penny Knight Campus van de Universiteit van Oregon voor het versnellen van wetenschappelijke impact.
"Dit is een enorm verschil. Verwacht wordt dat ons verbeterde enzym het gliale litteken nog effectiever zal afbreken dan de versie die gewoonlijk door andere onderzoeksgroepen wordt gebruikt, ', zegt Hettiarachi.
De volgende stap zal zijn om het enzym in te zetten in dezelfde soorten experimenten waar het wildtype eerder werd gebruikt.
“Toen we aan dit project begonnen, we kregen het advies om het niet te proberen, want het zou zijn zoeken naar een speld in een hooiberg, "zegt Shoichet. "Nadat ik die naald had gevonden, we onderzoeken deze vorm van het enzym in onze modellen van beroerte en ruggenmergletsel om het potentieel ervan als therapeutisch, alleen of in combinatie met andere strategieën."
Shoichet wijst op het multidisciplinaire karakter van het project als een sleutel tot het succes ervan.
"We hebben kunnen profiteren van de complementaire expertise van de auteurs om dit project tot een goed einde te brengen, en we waren geschokt en dolblij dat we zo succesvol waren, "zegt ze. "Het ging veel verder dan onze verwachtingen."
 Plantaardige eiwitten vervangen op aardolie gebaseerde grondstoffen
Plantaardige eiwitten vervangen op aardolie gebaseerde grondstoffen Chiraliteit van vitamine D-derivaat beïnvloedt de protoneringstoestanden van zijn receptoreiwit
Chiraliteit van vitamine D-derivaat beïnvloedt de protoneringstoestanden van zijn receptoreiwit Studie beschrijft hoe externe krachten de herschikking van individuele deeltjes in ongeordende vaste stoffen aandrijven
Studie beschrijft hoe externe krachten de herschikking van individuele deeltjes in ongeordende vaste stoffen aandrijven Hoe volume basen en volume zuren in titratie
Hoe volume basen en volume zuren in titratie Wat is de energiebron voor chemosynthese?
Wat is de energiebron voor chemosynthese?
 Wat veroorzaakte de Dust Bowl?
Wat veroorzaakte de Dust Bowl?  Bodemgezondheid kan klimaatverandering van meet af aan bestrijden
Bodemgezondheid kan klimaatverandering van meet af aan bestrijden Hoe oude gewassen de effecten van klimaatverandering kunnen tegengaan
Hoe oude gewassen de effecten van klimaatverandering kunnen tegengaan Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen
Onderzoekers beoordelen waterveiligheid van Centraal-Aziatische landen Nieuwe eDNA-technologie die wordt gebruikt om koraalriffen snel te beoordelen
Nieuwe eDNA-technologie die wordt gebruikt om koraalriffen snel te beoordelen
Hoofdlijnen
- Onverwachte bevinding in de energiecentrale van cellen
- Hier is hoe planten- en dierencellen verschillen
- Krillgedrag brengt koolstof naar de diepten van de oceaan
- Hoe onderhoudt een cel homeostase?
- Het genoom van de zeekomkommer wijst op genen voor weefselregeneratie
- Evolutionair gewasonderzoek:Egoplanten geven lagere opbrengst
- De definitie van moleculaire celbiologie
- Doorbreken van peulvruchten gewas wilde relatieve barrière
- Wat doet een bladcel?
- De zwavelshuttle stoppen voor betere batterijen

- Henneptestlab gelanceerd als antwoord op de behoefte van de industrie

- Singlet-zuurstof breekt selectief oxytetracycline af in fenton-achtige oxidatie

- Flexibiliteit en rangschikking - de interactie van ribonucleïnezuur en water
- Berekeningsanalyse ontrafelt het complexe gedrag van een polymeer

 Cysteïnesynthese was een belangrijke stap in het ontstaan van leven:studie
Cysteïnesynthese was een belangrijke stap in het ontstaan van leven:studie Onderzoekers vinden kritieke beveiligingsfouten in AMD-chips
Onderzoekers vinden kritieke beveiligingsfouten in AMD-chips Gelijkwaardigheid in virtueel leren bevorderen
Gelijkwaardigheid in virtueel leren bevorderen Zonnewetenschap heeft een mooie toekomst op de maan
Zonnewetenschap heeft een mooie toekomst op de maan Hernieuwbare, niet-hernieuwbare en niet-uitputbare bronnen
Hernieuwbare, niet-hernieuwbare en niet-uitputbare bronnen  Nabijheid van land bepaalt hoe koraalrifgemeenschappen reageren op klimaatveranderingen
Nabijheid van land bepaalt hoe koraalrifgemeenschappen reageren op klimaatveranderingen Wetenschappers ontdekken nieuwe exoplaneet met een atmosfeer die rijp is voor studie
Wetenschappers ontdekken nieuwe exoplaneet met een atmosfeer die rijp is voor studie VK worstelt om gelijke tred te houden met de gevolgen van klimaatverandering
VK worstelt om gelijke tred te houden met de gevolgen van klimaatverandering
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Swedish | German | Dutch | Danish | Norway | Spanish | Portuguese |

-
Wetenschap © https://nl.scienceaq.com

