
Wetenschap
Peptiden die als pil kunnen worden ingenomen

Structuur van een dubbelgebrugd peptide dat niet wordt afgebroken door enzymen in de maag en darmen. De twee stabiliserende chemische bruggen zijn in rood weergegeven. Krediet:C. Heinis (EPFL)
Peptiden zijn korte ketens van aminozuren die in ons lichaam voorkomen, in planten of bacteriën om diverse functies te controleren. Verschillende peptiden worden gebruikt als medicijnen zoals insuline, die het metabolisme van suiker regelt; en ciclosporine, die orgaanafstoting na transplantaties onderdrukt. Meer dan 40 peptiden zijn al goedgekeurd als medicijn, inkomsten genereren in de miljarden. Er zijn momenteel enkele honderden op peptiden gebaseerde medicijnen in klinische onderzoeken.
Maar bijna geen van deze medicijn-peptiden kan oraal worden ingenomen. Omdat peptiden een belangrijk onderdeel van voedsel zijn, de maag en darmen herbergen talloze enzymen die ze kunnen afbreken, wat betekent dat de meeste op peptiden gebaseerde medicijnen de passage door het maagdarmkanaal niet overleven.
De hoop om stabielere peptiden te genereren kwam van 'cyclische' peptiden, waarvan de uiteinden met elkaar zijn verbonden door chemische bruggen waardoor ze stabieler zijn dan lineaire omdat hun ruggengraat minder flexibel is en dus moeilijker aan te vallen door enzymen. in 2018, de onderzoeksgroep van Christian Heinis bij EPFL ontwikkelde een peptideformaat genaamd double-bridged peptides, waar peptiden worden gecycliseerd door twee chemische bruggen die een nog hogere stabiliteit bieden. Ondanks het succes, de meeste van dergelijke peptiden waren niet stabiel genoeg om de enorme enzymatische druk in het maagdarmkanaal te overleven.
Nutsvoorzieningen, De groep van Heinis heeft een nieuwe methode ontwikkeld die tussen miljarden peptiden met dubbele brug die identificeert die binden aan een ziektedoelwit van belang en enzymen van het maagdarmkanaal overleven. De methode is gepubliceerd in Natuur Biomedische Technologie , en omvat drie stappen.
Eerst, miljarden genetisch gecodeerde willekeurige peptidesequenties worden gecycliseerd door twee chemische bruggen die conformationele beperkingen opleggen aan de ruggengraat van de peptiden, zodat ze moeilijker door enzymen kunnen worden aangevallen. Tweede, deze bibliotheek van peptiden wordt blootgesteld aan enzymen uit de darm van de koe om al die peptiden te elimineren die niet stabiel zijn. In de derde en laatste stap, de wetenschappers dompelen doeleiwitten in de pool van overlevende peptiden om die eruit te vissen die zich aan het gewenste ziektedoelwit binden. "Het is een beetje zoeken naar een speld in een hooiberg, en deze methode maakt dit gemakkelijk, ' zegt Heinis.
Met deze methode, de onderzoekers zijn er voor het eerst in geslaagd om doelspecifieke peptiden te ontwikkelen die de afbraak in het maagdarmkanaal kunnen weerstaan. Bijvoorbeeld, ze gaven muizen een loodpeptide dat trombine remt - een belangrijk doelwit tegen trombose - in de vorm van een pil. Het peptide bleef intact in de maag en darmen, en hoewel het in vrij kleine hoeveelheden de bloedbaan bereikte, het meeste bleef volledig intact over het gehele maagdarmkanaal. Dit is een belangrijke stap in de richting van het ontwikkelen van orale peptidegeneesmiddelen.
Heinis' groep past nu de nieuwe methode toe om orale peptiden te ontwikkelen die direct inwerken op gastro-intestinale doelen, wat betekent dat ze niet in de bloedbaan hoeven te reizen. "We richten ons op chronische ontstekingsziekten van het maagdarmkanaal zoals de ziekte van Crohn en colitis ulcerosa, evenals bacteriële infecties, ", zegt Heinis. "We zijn er al in geslaagd om enzymresistente peptiden te genereren tegen de interleukine-23-receptor, een belangrijk doelwit van deze ziekten, die wereldwijd miljoenen patiënten treffen zonder dat er een oraal medicijn beschikbaar is."
 Krachtige antimicrobiële gevonden die veelbelovend is in het bestrijden van stafylokokbesmettingen
Krachtige antimicrobiële gevonden die veelbelovend is in het bestrijden van stafylokokbesmettingen Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren
Bedrieglijk eenvoudig proces kan de recycling van kunststoffen stimuleren Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof?
Hoe maken we waterstof uit steenkool, en is het echt een schone brandstof? Een minerale spons gebruiken om uranium op te vangen
Een minerale spons gebruiken om uranium op te vangen Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden
Voor fotokatalysatoren, de tand des tijds doorstaan betekent een perfecte partner vinden
 Chemische stoffen die worden gebruikt om Stickfast-vlooien te doden
Chemische stoffen die worden gebruikt om Stickfast-vlooien te doden  Klimaatfonds keurt 1 miljard dollar goed voor projecten in arme landen
Klimaatfonds keurt 1 miljard dollar goed voor projecten in arme landen Vertragingen in landgebruik kunnen klimaatinspanningen belemmeren
Vertragingen in landgebruik kunnen klimaatinspanningen belemmeren Schokzwerm nabij de grens tussen Californië en Mexico trekt de aandacht van wetenschappers
Schokzwerm nabij de grens tussen Californië en Mexico trekt de aandacht van wetenschappers Klimaatverandering verantwoordelijk voor warmste winter in Nieuw-Zeeland
Klimaatverandering verantwoordelijk voor warmste winter in Nieuw-Zeeland
Hoofdlijnen
- Commerciële voorouderstests kunnen onthullen hoeveel Neanderthaler-DNA u heeft
- Wat doet de DNA-nucleotide volgorde code voor?
- Belangrijke plantensoorten kunnen belangrijk zijn voor het ondersteunen van bestuivers van wilde bloemen
- Bron van Beperking Enzymes
- Chronische verspillende ziekte:de problemen met de prionziekte van hertachtigen aanpakken
- Het behoud van Jaguar hangt af van de houding van de buren
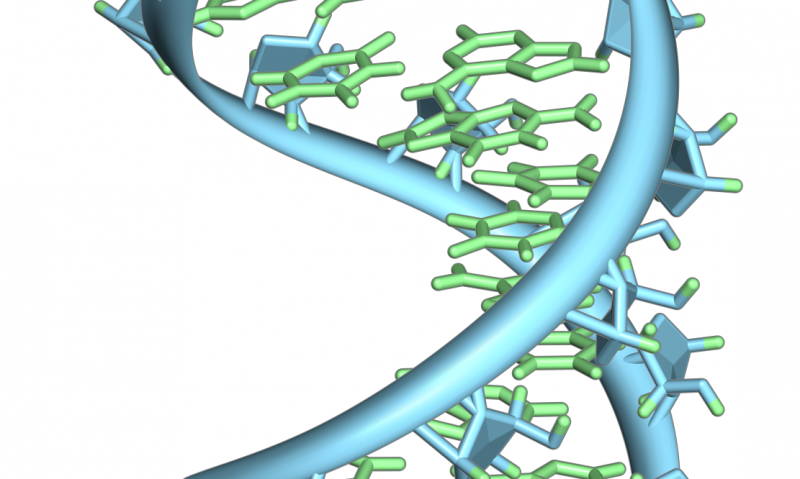
- Wat zijn de subeenheden van DNA?
- Een titerrapport lezen
- Wat gebeurt er met je cellen als je uitgedroogd bent?
- Het breken van de regels van de chemie ontgrendelt een nieuwe reactie
- Batterijen verborgen laag onthuld
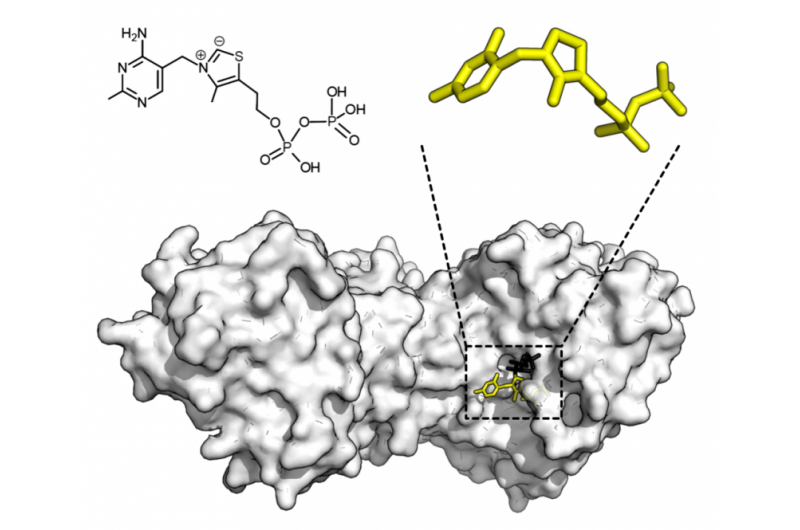
- Een wetenschappelijk datingspel - biologen spelen RNA-eiwit matchmakers
- Een nanotech-sensor die moleculaire vingerafdrukken omzet in streepjescodes

- Een SN1-reactie gebruiken om quaternaire stereocentra te maken
 Geowetenschappers documenteren de rol van atmosferisch stof op mariene ecosystemen 300 miljoen jaar geleden
Geowetenschappers documenteren de rol van atmosferisch stof op mariene ecosystemen 300 miljoen jaar geleden Cellen gebruiken concentratiegradiënten als kompas
Cellen gebruiken concentratiegradiënten als kompas De gevaren en voordelen van vulkanen in Oost-Afrika volgen
De gevaren en voordelen van vulkanen in Oost-Afrika volgen NASA vangt tropische cycloon Pola in de buurt van Fiji
NASA vangt tropische cycloon Pola in de buurt van Fiji Het belang van verantwoording na dodelijke rampen
Het belang van verantwoording na dodelijke rampen Hubble vindt Greater Pumpkin-sterrenstelselpaar
Hubble vindt Greater Pumpkin-sterrenstelselpaar Kan Mario Kart ons leren hoe we de armoede in de wereld kunnen verminderen en de duurzaamheid kunnen verbeteren?
Kan Mario Kart ons leren hoe we de armoede in de wereld kunnen verminderen en de duurzaamheid kunnen verbeteren? Mechanische geheugenkaarten bouwen met origami
Mechanische geheugenkaarten bouwen met origami
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

