
Wetenschap
Een SN1-reactie gebruiken om quaternaire stereocentra te maken
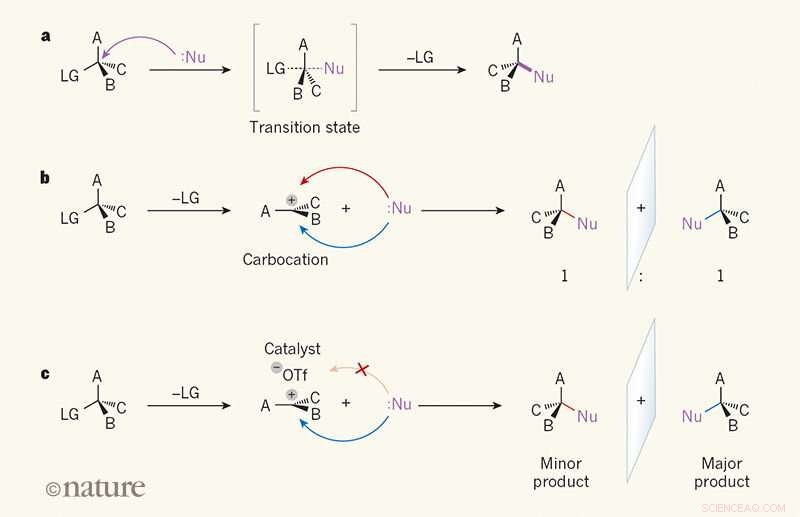
Spiegelbeeldselectiviteit bij substitutiereacties. een, In een SN2-reactie, een reactant genaamd een nucleofiel (Nu; stippen geven een eenzaam elektronenpaar aan) valt een koolstofatoom in een organisch molecuul aan vanaf de kant tegenover een 'vertrekkende' groep (LG). EEN, B en C kunnen elk atoom of elke groep zijn. In de overgangstoestand, de binding tussen het koolstofatoom en de LG is gedeeltelijk verbroken, en een binding tussen Nu en het koolstofatoom wordt gedeeltelijk gevormd (gedeeltelijk verbroken en gedeeltelijk gevormde bindingen worden weergegeven als stippellijnen). De binding met de LG verbreekt dan, en een enkel product wordt gevormd. B, In de SN1-reactie, de LG wordt eerst uitgebracht, en een vlakke, geladen tussenproduct genaamd carbokation vormen. Omdat de Nu de carbokation even gemakkelijk van beide kanten kan aanvallen, het product vormt een 1:1 verhouding van spiegelbeeldisomeren (enantiomeren). C, Wendlandt et al.1 rapporteren een SN1-reactie waarbij een katalysator met een klein molecuul en een triflaat-ion (-OTf) aan één kant van het carbokation binden, de nucleofiel naar de andere kant leiden. Daarom wordt bij voorkeur één enantiomeer geproduceerd. Credit: Natuur (2018). DOI:10.1038/s41586-018-0042-1
Een team van onderzoekers van de Harvard University in de VS heeft een manier ontwikkeld om ons een SN1-reactie te geven om quaternaire koolstofstereocentra te maken. In hun artikel gepubliceerd in het tijdschrift Natuur , het team beschrijft het overwinnen van de neiging van SN1-reacties om stereochemie te vernietigen om het koolstof-gecentreerde materiaal te maken. Tobias Morack en Ryan Gilmour van de Universiteit van Münster in Duitsland, bied een News &Views-stuk aan over de studie in hetzelfde tijdschriftnummer.
Zoals de onderzoekers opmerken, tot nu toe, er is geen goede methode geweest om quaternaire stereocentra te maken. huidige methoden, zij merken op, zijn meestal gebaseerd op pro-chirale substraten, die zelf een uitdaging zijn om te maken. In deze nieuwe poging het team van Harvard kwam met een nieuwe aanpak - een gebaseerd op de SN1-reactie.
SN1-reacties zijn een steunpilaar van inleidende cursussen organische chemie, maar ze veroorzaken notoir ravage met stereochemie. Ondanks dat, de onderzoekers geloofden dat ze het platte carbokation-tussenproduct dat in dergelijke reacties werd geproduceerd, als substraat konden gebruiken. Daartoe, ze bedachten een SN1-reactie die een mengsel van propargylacetaat (met gelijke hoeveelheden links- en rechtshandige enantiomeren - een racemisch) omgezet in een mengsel met een quaternair centrum. Een waterstofbrugdonor werd gebruikt als katalysator om de acetoxymaterialen te verwijderen die werden vervangen door een allylmengsel - het resultaat was een enkele enantiomeer.
De eindproducten waren interessant, Morack en Gilmour noteren, omdat de koolstofstereocentra een breed scala aan elektronenorbitalen hadden. Dit betekent dat ze verschillende fysieke geometrieën hebben en dus anders reageren. Dit opent de deur om ze te gebruiken om een grote verscheidenheid aan moleculen te produceren die in verschillende reacties kunnen worden gebruikt voor het synthetiseren van nieuwe chemicaliën.
De onderzoekers merken op dat ze nog niet klaar zijn met het werk - ze zijn van plan om dezelfde aanpak te proberen met verbindingen die niet zo stabiel zijn. Als je dat doet, zij erkennen, zal het gebruik van een katalysator vereisen die nog reactiever is. Ze zijn ook van plan om de reactie met verschillende nucleofielen te onderzoeken.
© 2018 Fys.org
 Massaspectrometrietechniek helpt bij het identificeren van vervalste manuscripten van Robert Burns
Massaspectrometrietechniek helpt bij het identificeren van vervalste manuscripten van Robert Burns Solid-state batterijen kunnen schoner worden gemaakt door flash-sintering op te schalen
Solid-state batterijen kunnen schoner worden gemaakt door flash-sintering op te schalen Acetaatbuffers voorbereiden
Acetaatbuffers voorbereiden Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen
Upcycling van plastic afval tot hoogwaardige mechanische smeermiddelen Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie
Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie
 Meten van de geluidssnelheid van Majorite onder omstandigheden van mantelovergangszones
Meten van de geluidssnelheid van Majorite onder omstandigheden van mantelovergangszones Kustwacht onderzoekt vrachtschip dat zich in de buurt van enorme olieramp in Orange County bevond
Kustwacht onderzoekt vrachtschip dat zich in de buurt van enorme olieramp in Orange County bevond Smeltende gletsjers, evenals ijskappen, het verhogen van de zeeën van de aarde
Smeltende gletsjers, evenals ijskappen, het verhogen van de zeeën van de aarde Klein lek gevonden van nucleaire Sovjet-onderzeeër die in 1989 zonk
Klein lek gevonden van nucleaire Sovjet-onderzeeër die in 1989 zonk Effectief communiceren van tsunami-evacuaties
Effectief communiceren van tsunami-evacuaties
Hoofdlijnen
- Wat zijn de voordelen van Ribosomes?
- Onderzoek toont verschillen in energieverteerbaarheid tussen zeugen en gelten
- Nieuwe aanwijzingen uit hersenstructuren van bidsprinkhaangarnalen
- Waarom verplaatsen chloroplasten zich in Elodea?
- De effecten van straling op dieren
- Kunnen planten denken?
- Vergelijking voor glucosemetabolisme
- Wetenschappers werken aan een omkeerbare vorm van genbewerking
- In de mangoestenmaatschappij immigranten zijn een bonus - als ze tijd krijgen om zich te vestigen
- Nieuwe structurele details over de specifieke rangschikking van atomen in geconjugeerde polymeren
- Glucagon-receptorstructuur biedt nieuwe mogelijkheden voor het ontdekken van geneesmiddelen voor type 2 diabetes
- Hete OLED's kunnen terugschakelen
- Nieuw hulpmiddel voor de kristallisatie van eiwitten
- Wetenschappers ontwikkelen unieke materialen om beschadigde organen en weefsels te herstellen

 Er is een nieuw nanoactuatorsysteem ontwikkeld
Er is een nieuw nanoactuatorsysteem ontwikkeld XENON1T-experimentele gegevens stellen de strengste limiet voor donkere materie vast
XENON1T-experimentele gegevens stellen de strengste limiet voor donkere materie vast Hoe vind ik bladluizen voor mijn lieveheersbeestje
Hoe vind ik bladluizen voor mijn lieveheersbeestje Ingenieurs creëren met precisie atomair dunne superroostermaterialen
Ingenieurs creëren met precisie atomair dunne superroostermaterialen Doorbraak gerapporteerd in transconductantie bij inkjetprinten
Doorbraak gerapporteerd in transconductantie bij inkjetprinten NASA analyseert waterdampconcentratie van tropische cycloon Damiens
NASA analyseert waterdampconcentratie van tropische cycloon Damiens Hoe een nucleaire aanval te overleven?
Hoe een nucleaire aanval te overleven?  Kosmische beesten en waar ze te vinden zijn
Kosmische beesten en waar ze te vinden zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

