Wetenschap
Studie onthult de ingewikkelde manier waarop twee eiwitten interageren om celbeweging te bevorderen, metastase
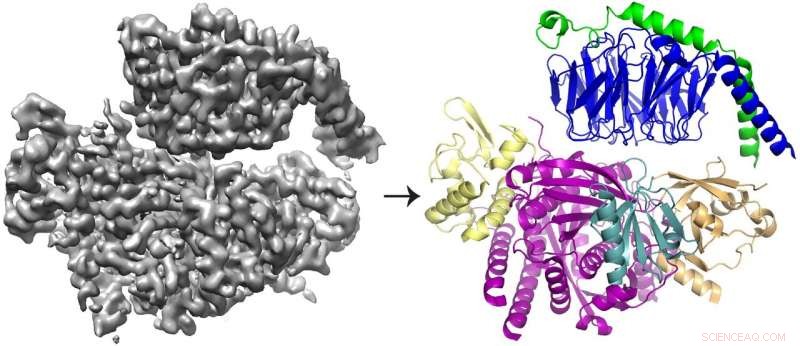
De cryo-EM 3D-reconstructie (links) van het eiwit P-Rex1 gebonden aan Gβγ en het eiwitmodel (rechts) dat laat zien dat Gβγ (boven; blauw en groen) bindt aan een compact, multi-domein oppervlak op P-Rex1 (onder; geel, magenta, blauwgroen en goud). Krediet:Jennifer Cash, UM LifeSciences Institute.
Wanneer cellen in ons lichaam moeten bewegen - om een infectie aan te vallen of een wond te genezen, bijvoorbeeld - cellulaire eiwitten verzenden en ontvangen een cascade van signalen die de cellen op het juiste moment naar de juiste plaats leiden. Het is een proces dat kankercellen kunnen kapen om zich naar nieuwe weefsels en organen te verspreiden.
Nutsvoorzieningen, een team van onderzoekers onder leiding van het Life Sciences Institute van de Universiteit van Michigan heeft licht geworpen op een belangrijke aanjager van dit proces. De bevindingen, gepland voor publicatie op 16 oktober in wetenschappelijke vooruitgang , bieden belangrijke inzichten in celmigratie, niet alleen onder normale gezondheidscondities, maar ook in de borst, prostaatkanker en andere vormen van kanker.
De onderzoekers onderzochten specifiek een eiwit genaamd P-Rex1 (fosfatidylinositol 3, 4, 5-trifosfaat-afhankelijke Rac-wisselaar 1), die wordt geactiveerd wanneer het een ander eiwit bindt, GB. Ondanks de ontdekking van P-Rex1 meer dan 15 jaar geleden, precies hoe de twee eiwitten interageren en hoe deze interactie tot celbeweging leidt, is nog steeds slecht begrepen.
Met behulp van een combinatie van structurele biologie en biochemische technieken, de onderzoekers hebben de structuur van P-Rex1 gebonden aan Gbg onthuld, een momentopname van hoe dit ingewikkelde activeringsproces zich ontvouwt.
"Het kennen van de structuur van dit eiwitcomplex biedt mechanistische details die ons in staat stellen te begrijpen hoe het wordt gereguleerd, " zei Jennifer Cash, LSI-onderzoeker en hoofdauteur van de studie. "En als we begrijpen hoe het gereguleerd is, we kunnen beginnen na te denken over hoe we die regulatie kunnen wijzigen en P-Rex1-signalering bij kankers kunnen remmen."
Het team ontdekte dat Gbg bindt aan een uitgebreid oppervlak op P-Rex1 dat uit verschillende eiwitdomeinen bestaat. Eerdere studies leverden tegenstrijdige argumenten op over welk domein (of welke domeinen) Gbg gebonden was. Maar deze laatste studie was in staat om het conflict op te lossen door een groter beeld van het eiwit te nemen, nieuwere technologieën gebruiken.
"We wilden naar het enzym als geheel kijken - en om dat te doen, we moesten echt over op cryo-EM, " zei John Tesmer, hoogleraar biologische wetenschappen aan de Purdue University en een van de senior auteurs van de studie.
Cryo-EM, of cryo-elektronenmicroscopie, stelt onderzoekers in staat om eiwitten te bestuderen die niet kunnen worden gevisualiseerd met andere structurele biologietechnieken, zoals de complexe, verweven structuur van P-Rex1. Het proces omvat het bevriezen van eiwitten in een dunne laag water en vervolgens met behulp van elektronen om beelden van hun vorm vast te leggen. Honderdduizenden afbeeldingen worden vervolgens gemiddeld om een 3D-structuur te creëren.
Naast het verduidelijken hoe Gbg bindt aan en activeert P-Rex1, deze nieuwe bevindingen vormen een belangrijke toetssteen in de ontwikkeling van cryo-EM, zei Michael Cianfrocco, LSI-assistent-professor en senior auteur van de studie.
De meeste structuren bepaald met cryo-EM zijn groter, symmetrische moleculen. De resultaten voor P-Rex1, in tegenstelling tot, vertegenwoordigen een structuur met hoge resolutie van het kleinste asymmetrische eiwit dat tot nu toe door cryo-EM is bereikt. Verder, een groot domein in P-Rex1 heeft een structuur of vouw die niet eerder was geïdentificeerd in een ander zoogdiereiwit, waarbij het team het stuk voor stuk moest bouwen - een moeilijke taak met cryo-EM-gegevens.
"Cryo-EM is nog een relatief nieuw veld, en mensen zijn echt geïnteresseerd in hoe ver de grenzen kunnen worden verlegd, zei Cianfrocco, die ook een assistent-professor biologische chemie is aan de UM Medical School.
De Science Advances-papers zijn getiteld "Cryo-elektronenmicroscopiestructuur en analyse van de P-Rex1-Gbg-signaleringssteiger."
Hoofdlijnen
- Massive Angel Oak is getuige geweest van 500 jaar geschiedenis van South Carolina
- Is er een psychologische reden waarom mensen gemeen zijn op internet?
- Entomoloog ontdekt ongewervelde dieren die in meer kleurencombinaties voorkomen dan alle andere
- Wat zijn organellen in een prokaryotische cel?
- Handelen of niet handelen? De ivoren impasse doorbreken
- Zouden herten aanwijzingen kunnen bevatten over het verband tussen malariaresistentie en sikkelcel?
- Een 3D-plantencel maken met huishoudelijke materialen
- What Influences Phenotype?
- Koloniekenmerken van E.Coli
 Een nieuwe stap naar het gebruik van grafeen in elektronische toepassingen
Een nieuwe stap naar het gebruik van grafeen in elektronische toepassingen Tienvoudige CO2-reductie nodig om klimaatdoelstelling Parijs te halen
Tienvoudige CO2-reductie nodig om klimaatdoelstelling Parijs te halen Zeldzame aardkers kan binnenkort overal zijn,
Zeldzame aardkers kan binnenkort overal zijn,  Zijn luie mensen efficiënter en innovatiever dan we denken?
Zijn luie mensen efficiënter en innovatiever dan we denken? Hoogtepunt:piëzorespons op nanoschaal van ferro-elektrische domeinen
Hoogtepunt:piëzorespons op nanoschaal van ferro-elektrische domeinen Kunnen zware objecten zweven in kwik?
Kunnen zware objecten zweven in kwik?  Stop en ga in het kaliumkanaal
Stop en ga in het kaliumkanaal Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert
Groot buitenonderzoek toont aan dat biodiversiteit de stabiliteit van algenbiobrandstofsystemen verbetert
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com