
Wetenschap
Levende mitochondriën in ongekend detail gezien:fotobleken in STED-microscopie overwonnen
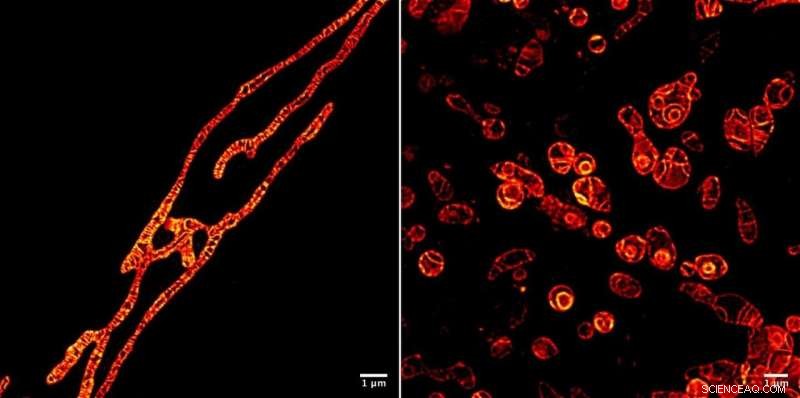
Binnenmembranen van levende mitochondriën onder een STED-microscoop afgebeeld met behulp van de MitoPB Yellow fluorescerende markermolecuul gemaakt door onderzoekers van het Institute of Transformative Bio-Molecules (ITbM) aan de Universiteit van Nagoya. De buitenste membranen van de mitochondriën zijn onzichtbaar. Het markermolecuul is relatief lang bestand tegen de STED-straal, die time-lapse beeldvorming van het levende onderwerp mogelijk maakt. Monstervoorbereiding is veel gemakkelijker voor een optische microscoop dan een transmissie-elektronenmicroscoop (TEM), ongeveer een uur nodig in plaats van een dag. Cellen kunnen niet levend worden afgebeeld met behulp van TEM. De mitochondriën zijn behandeld met een reagens dat DNA-replicatie onderdrukt, het veroorzaken van disfunctie, om hun overleving (links) en stervende (rechts) processen te zien. Het kunnen zien van de disfunctieprocessen die plaatsvinden in mitochondriën zal leiden tot een betere manier om menselijke mitochondriale ziekten te diagnosticeren - en misschien zelfs tot genezing. Krediet:© ITbM, Universiteit van Nagoya
Lichtmicroscopie is de enige manier waarop we in een levende cel kunnen kijken, of levende weefsels, in drie dimensies. Een elektronenmicroscoop geeft alleen een tweedimensionaal beeld, en het organische monster zou snel verbranden vanwege de extreme hitte van de elektronenstraal, en kan daarom niet levend worden waargenomen. Bovendien, door de biomoleculen van de structuur waarin we geïnteresseerd zijn te markeren met een speciaal ontworpen fluorescerend molecuul, we kunnen het onderscheiden van de omgeving:dit is fluorescentiemicroscopie.
Tot het midden van de jaren negentig werd fluorescentiemicroscopie gehinderd door elementaire fysica:vanwege de diffractielimiet, alle kenmerken op het monster dichter bij elkaar dan ongeveer 250 nanometer zouden samen vervaagd zijn. Virussen en individuele eiwitten zijn veel kleiner dan dit, dus ze konden niet op deze manier worden bestudeerd. Maar rond 1994 in een prachtige les die ons leert dat we voorzichtig moeten zijn bij het toepassen van fundamentele fysieke principes, Stefan Hell ontdekte Stimulated Emission Depletion (STED) microscopie, wat nu een van de vele optische microscopiebenaderingen is die "superresolutie, " resolutie voorbij de diffractielimiet. Hij ontving de Nobelprijs voor scheikunde in 2014 "voor de ontwikkeling van super-opgeloste fluorescentiemicroscopie, " samen met Eric Betzig en William Moerner.
Om te zien waarom de diffractielimiet een probleem is, stel je voor dat de interessestructuur erg klein is, zeggen, 50 nanometer breed, als een virus, en is gemarkeerd met een fluorescerend biomolecuul. Stel je nu voor dat je het verlicht met een laserspot, zeggen, 200 nanometer in doorsnee. De verlichte markermoleculen zenden spontaan licht uit, op willekeurige momenten, door fluorescentie, waarbij de kans snel afneemt met de tijd. De fotonen van veel fluorescerende moleculen worden met behulp van lenzen op een detector gefocusseerd, het creëren van een enkele functieloze pixel. Het is niet helemaal helder omdat slechts een klein deel van het monster in de verlichte cirkel fluorescerende moleculen bevat. Als je de laser 200 nanometer in een willekeurige richting zou bewegen, waarheen, in dit voorbeeld, er zijn geen fluorescerende moleculen aanwezig, het signaal zal zeker donker worden. Dus, deze nogal zwakke pixel vertelt ons dat er iets aanwezig is in dit monstergebied met een diameter van 200 nanometer. De diffractielimiet voorkomt dat we pixels vormen uit kleinere gebieden, als we de basisbenadering gebruiken.
Het fysieke idee van STED-microscopie is heel eenvoudig. Met de laservlek die het gebied rond de kleine fluorescerende structuur opnieuw verlicht, stel dat je op de een of andere manier stopt dat er licht naar de detector wordt gestuurd vanuit een zo groot mogelijk gebied binnen de plek - waardoor een veel kleinere plek overblijft, zeggen, 60 nanometer in doorsnee. Als je nu de laser 60 nanometer in een willekeurige richting beweegt en het signaal wordt donker, de pixel in de afbeelding vertegenwoordigt de aanwezigheid van een structuur tot 60 nanometer breed. De diffractielimiet is overschreden. Natuurlijk, een zo'n pixel is functieloos, maar een scherp beeld van mitochondriën kan worden opgebouwd door over veel pixels van verschillende helderheid te scannen en deze op te nemen. (Zie figuur 1. "Time-gated STED-microscopie" werd gebruikt om de meeste afbeeldingen in dit artikel vast te leggen.)
Stefan Hells Nobelprijswinnende ontdekking bestaat uit twee inzichten. Eerst, hij bedacht het idee om het licht te stoppen dat naar de detector wordt gestuurd vanuit een zo groot mogelijk gebied binnen een verlichte plek waarvan de grootte overeenkomt met de diffractielimiet. Tweede, hij bedacht hoe hij het daadwerkelijk kon bereiken.
Twee lasers verlichten dezelfde plek. De eerste laser prikkelt de elektronen van het markermolecuul en ze vervallen spontaan terug naar hun grondtoestand, elk zendt een zichtbaar foton uit met een specifieke golflengte. (Dit is fluorescentie.) Het proces is willekeurig, waarbij de emissiewaarschijnlijkheid vrij snel afneemt met de tijd, wat betekent dat de meeste fotonen worden uitgezonden binnen de eerste paar nanoseconden nadat het monster wordt verlicht. Een tweede laser, de "STED-straal, " gevormd met een gat in het midden om de markermoleculen daar niet te beïnvloeden, is afgestemd om de emissie van een foton door het geëxciteerde markermolecuul in de buitenste ring te stimuleren. Maar hoe onderscheiden deze fotonen zich van fotonen die vanuit het midden worden uitgezonden?
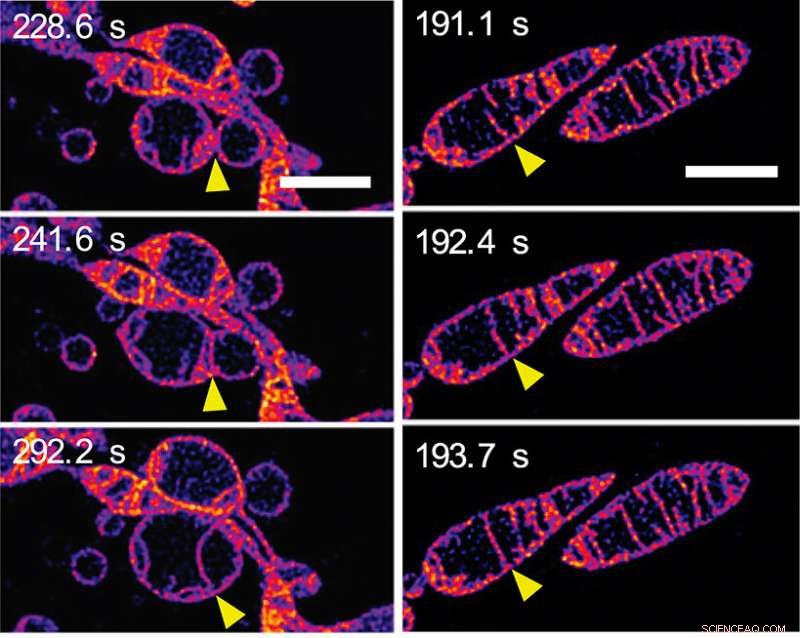
Als reactie op het gebrek aan voedingsstoffen, mitochondriën smelten samen en verhogen het aantal cristae. (a) Frames van een time-lapse-sequentie die twee afzonderlijke mitochondriën toont die samensmelten om een enkel mitochondrion te vormen. De buitenste membranen van de mitochondriën zijn onzichtbaar:we zien de binnenste membranen samensmelten. (b) Frames van een time-lapse-sequentie die twee cristae toont in een enkel mitochondrion dat samensmelt. (Zie Video 2 in het aanvullende materiaal op de PNAS-webpagina van het papier.) De schaalbalken vertegenwoordigen 2 mm. Krediet:© ITbM, Universiteit van Nagoya
Het emissieproces van de buitenste ring is ook willekeurig, maar gebeurt veel sneller, de kans neemt snel af, wat betekent dat de meeste van deze fotonen binnen een nanoseconde of zo worden uitgezonden. Terwijl de twee boven elkaar liggende bundels over het monster scannen, tegen de tijd dat het midden van de ring fluoresceert, de omringende moleculen zijn al in hun grondtoestand gedwongen door een foton uit te zenden - ze zijn 'uitgeschakeld'. De STED-microscopietechniek steunt op deze manier op slimme timing. In principe, de grootte van de gloeiende centrale plek kan zo klein worden gemaakt als je wilt, dus elke oplossing is mogelijk. Echter, de donutvormige "STED-straal" zou dan energie leveren in de vorm van geconcentreerd zichtbaar laserlicht aan een groter gebied van de levende cel, het risico lopen het te doden.
Hoe dan ook, het proces is niet ideaal, en het resulterende beeld verliest wat scherpte omdat sommige markermoleculen in de buitenste ring niet goed zijn uitgeschakeld - het proces is waarschijnlijk, tenslotte - en als ze fluoresceren, besmetten ze het signaal van het centrum. Echter, vanwege de verschillende timing van de spontane en gestimuleerde emissie, de vroegste fotonen die bij de detector aankomen, komen uit gebieden die worden verlicht door de hoogste STED-straalintensiteit, en de laatste fotonen die aankomen zijn hoogstwaarschijnlijk afkomstig van markermoleculen die zich op de centrale plek bevinden. Dus door een korte tijd (ongeveer een nanoseconde) te wachten voordat u het beeld opneemt, de meeste fotonen uit de buitenste ring kunnen worden uitgefilterd. Dit wordt "Time-gated STED-microscopie" genoemd. Verdere verscherping van het beeld wordt bereikt door een proces dat deconvolutie wordt genoemd.
De uitvinding van superresolutiemicroscopie luidde een sprong voorwaarts in de levenswetenschappen in. Levende organismen konden met een ongekende resolutie worden waargenomen. Echter, time-lapse-reeksen van beelden konden niet over een behoorlijke tijdsduur worden gemaakt, omdat de markermoleculen zouden degraderen onder de intense STED-straal en zouden stoppen met fluoresceren. Dit is het fotobleekprobleem. De beschadigde markermoleculen kunnen ook giftig worden voor de cel.
Het fotobleekprobleem opgelost
Shigehiro Yamaguchi en Masayasu Taki, van Nagoya University's Institute for Transformative Bio-Molecules (ITbM), leidde een onderzoeksteam dat een markermolecuul heeft ontwikkeld, genaamd "MitoPB Geel, " die wordt geabsorbeerd door het binnenmembraan van mitochondriën, inclusief de cristae - de vouwachtige structuren - en heeft een lange levensduur onder een STED-balk. Het idee voor het markermolecuul dat mitochondriën target, kwam van co-auteur Chenguang Wang, van het ITbM. Multicolour STED-beeldvorming met een enkele STED-laser is ook mogelijk; en de onderzoekers verwachten dat fluorescerende markers vergelijkbaar met MitoPB Yellow ook een breed scala aan toepassingen zullen vinden in andere superresolutietechnieken (zoals die ontwikkeld door Eric Betzig en William Moerner).
Om het praktische nut van MitoPB Yellow voor live-celbeeldvorming aan te tonen, de groep plaatste mitochondriën onder omstandigheden waarvan bekend is dat ze bepaalde structurele veranderingen veroorzaken, maar tot nu toe zijn deze alleen waargenomen met behulp van transmissie-elektronenmicroscopie, die niet op levende cellen kunnen worden gebruikt. De mitochondriën werden behandeld met een reagens dat DNA-replicatie onderdrukt, het veroorzaken van disfunctie, om hun overlevings- en stervensprocessen te observeren.
Vervolgens, met behulp van tijdgestuurde STED-microscopie, het onderzoeksteam maakte stilstaande beelden met een resolutie van 60 nanometer (ongeveer een duizendste van de breedte van een mensenhaar), evenals time-lapse-beeldsequenties die de mitochondriën laten zien die reageren op een tekort aan voedingsstoffen door van vorm te veranderen om te overleven. De lange beeldsequenties - tot 600 beelden - zijn de eerste ooit gemaakt van mitochondriën met de relatief hoge ruimtelijke resolutie van 90 nanometer. (Zie video 1, die een time-lapse-reeks toont die is opgenomen over bijna 7 minuten.)
Binnen een paar minuten veranderde de binnenste mitochondriale structuur op een aantal manieren drastisch. aanvankelijk, verlenging en toename van het aantal cristae werd gezien. Eén beeldsequentie (zie figuur 2a) toont binnenmembranen van naburige mitochondriën die samensmelten - met andere woorden, twee mitochondriën die samensmelten om er één te maken. Een andere afbeeldingsreeks (zie figuur 2b) toont twee cristae binnen een enkel mitochondrion dat blijkbaar samensmelt. Verlenging en het creëren van meer cristae wordt verondersteld de efficiëntie van energieproductie (ATP-synthese) te verhogen, terwijl het mitochondrium wordt beschermd tegen "autofagosomale afbraak" - een geprogrammeerde dood waarvan het doel is om onnodige of disfunctionele componenten uit de cel te verwijderen en de ordelijke afbraak en recycling mogelijk te maken van cellulaire componenten.
Na de aanvankelijke verlengingsperiode, de binnenmembranen van sommige mitochondriën splitsten zich in bolletjes die opzwollen en cristae verloren (zie film S2); sommige bolletjes scheurden (film S4). Sommige vormden concentrische bollen (Figuur 1 en Video 1). De fluorescentie-intensiteit bleef hetzelfde. Opmerkelijk hierbij is dat de cristae en membranen even scherp in beeld blijven als voorheen, wat aangeeft dat de doodsoorzaak van het mitochondrion geen toxiciteit is als gevolg van afbraak van het markermolecuul onder de straal. De extreem sterke STED-laser heeft mogelijk de mitochondriën beschadigd, hoewel precies waarom ze scheuren is onbekend.
Op deze afbeeldingen, na het zien van de eerste overlevingsreacties, we kijken naar de dood van mitochondriën onder de intense STED-straal. Een toekomstige onderzoeksrichting zal zijn om de intensiteit van de STED-laserstraal te verminderen door een fluorescerend markermolecuul te creëren dat gloeit wanneer het wordt verlicht door licht met een langere golflengte en daarom lagere energie. De mitochondriën leven dan mogelijk langer.
Echter, zelfs met MitoPB Geel, het stervensproces - dat niet goed wordt begrepen - kan worden bestudeerd. Niemand weet of de morfologische (structurele) veranderingen die tijdens het stervensproces worden waargenomen, verband houden met apoptose (normaal, gecontroleerde dood) of necrose (overlijden door letsel of storing). Van apoptose is bekend dat het wordt veroorzaakt door een signaalmolecuul dat cytochroom C wordt genoemd:als er een reagens kan worden gevonden dat cytochroom C onderdrukt, dan zouden mitochondriën - en menselijke cellen - langer kunnen leven.
Het kunnen zien van de processen die plaatsvinden in mitochondriën zou moeten leiden tot een betere manier om menselijke mitochondriale ziekten te diagnosticeren - en misschien zelfs tot genezing.
 Gebruikers van mobiele telefoons om de watervoorziening van landen te helpen beschermen
Gebruikers van mobiele telefoons om de watervoorziening van landen te helpen beschermen Toenemende CO2-niveaus verlagen de voedingswaarde van rijst
Toenemende CO2-niveaus verlagen de voedingswaarde van rijst Hoe AC FOX werkt
Hoe AC FOX werkt  Nieuwe brandstof om zeevracht milieuvriendelijk in orde te krijgen
Nieuwe brandstof om zeevracht milieuvriendelijk in orde te krijgen Wat ontbreekt er in projecties van bossterfte? Een kijkje onder de grond
Wat ontbreekt er in projecties van bossterfte? Een kijkje onder de grond
Hoofdlijnen
- Frankrijk verzet zich tegen EU-verlenging van 5 jaar voor onkruidverdelger glyfosaat
- Het korstmos dat zijn voortplantingsstrategie verandert afhankelijk van het klimaat
- Tsjaad breidt belangrijk natuurgebied in nationaal park uit
- Een geslacht van Europese papierwespen voor het eerst herzien met behulp van integratieve taxonomie
- Wat zijn de voordelen van Ribosomes?
- DNA-klonen: definitie, proces, voorbeelden
- "What is Pascals Triangle?
- Wat is de functie van de promotor in de transcriptie van DNA?
- Science Fair-projecten met nagellak
- Wanneer minder meer is:Designer-spleten maken glasachtige materialen veel sterker

- High-tech gel helpt bij het afleveren van medicijnen
- Nieuwe geautomatiseerde biologische monsteranalysesystemen om ziektedetectie te versnellen

- Levensrijk patroon:onderzoekers gebruiken geluid om de toekomst van printen vorm te geven

- Chemicus maakt de volgende generatie neurowetenschappelijke tools

 De keerzijde van de Bitcoin:hoe blockchain duurzame energie kan ondersteunen
De keerzijde van de Bitcoin:hoe blockchain duurzame energie kan ondersteunen Aardgasinformatie
Aardgasinformatie Nieuwe verweringsanalyse volgt nauwkeurig de geochemische flux onder het aardoppervlak
Nieuwe verweringsanalyse volgt nauwkeurig de geochemische flux onder het aardoppervlak Nieuwe microscopiemethode voor snelle en betrouwbare 3D-beeldvorming van kromlijnige nanostructuren
Nieuwe microscopiemethode voor snelle en betrouwbare 3D-beeldvorming van kromlijnige nanostructuren Spindynamiek van grafeen verklaard door supercomputing
Spindynamiek van grafeen verklaard door supercomputing Nieuwe test biedt nauwkeurige meting van DNA-schade door chemische verbindingen
Nieuwe test biedt nauwkeurige meting van DNA-schade door chemische verbindingen Het vangen van diversiteit aan vissoorten betekent een stabieler inkomen voor vissers
Het vangen van diversiteit aan vissoorten betekent een stabieler inkomen voor vissers Juist gebrekkige nanodiamanten zouden de volgende generatie hulpmiddelen voor beeldvorming en communicatie kunnen opleveren
Juist gebrekkige nanodiamanten zouden de volgende generatie hulpmiddelen voor beeldvorming en communicatie kunnen opleveren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | German | Dutch | Norway | Portuguese | Danish |

-
Wetenschap © https://nl.scienceaq.com

