
Wetenschap
Kunstmatige membraanbindende eiwitten om stamcellen naar het myocardium te leiden
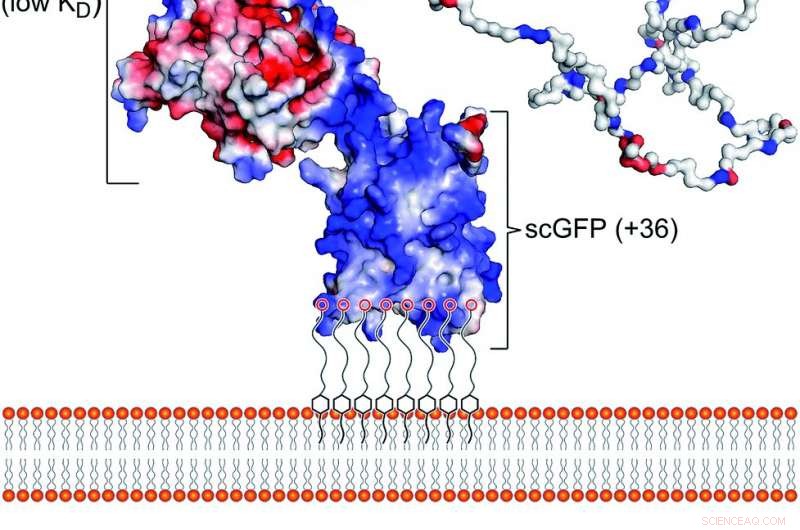
Fig. 1 Het kunstmatige plasmamembraan bindende construct. (a) Schematische weergave van de interactie van de aan polymeer surfactant geconjugeerde supercharged fusie [CshA_scGFP][S]-construct met de dubbellaag van het cytoplasmatische membraan. De structuur toont het oppervlakteladingspotentieel, het benadrukken van de hoge positieve lading (blauw) op het supercharged GFP-domein en de negatieve lading (rood) op het CshA bolvormige domein, evenals de domeinen "catch" en "clamp" van CshA. (b) De structuur van de anionische polymere oppervlakteactieve stof glycolzuurethoxylaat 4-nonylfenylether (S), die elektrostatisch een complex vormt met de supercharged GFP-groep. Krediet:Chemische Wetenschap, open toegang:https://pubs.rsc.org/en/content/articlelanding/2019/sc/c9sc02650a#!divAbstract
In een wereldprimeur, wetenschappers hebben een nieuwe manier gevonden om stamcellen naar hartweefsel te leiden. De bevindingen, geleid door onderzoekers van de Universiteit van Bristol en gepubliceerd in Chemische Wetenschappen , zou de behandeling van hart- en vaatziekten radicaal kunnen verbeteren, die meer dan een kwart van alle sterfgevallen in het VK veroorzaakt.
Daten, proeven met stamcellen, die van de patiënt of donor worden afgenomen en gekweekt en in het hart van de patiënt worden geïnjecteerd om beschadigd weefsel te regenereren, veelbelovende resultaten hebben opgeleverd.
Echter, terwijl deze celtherapieën van de volgende generatie in het verschiet liggen, aanzienlijke uitdagingen in verband met de distributie van de stamcellen zijn gebleven. Hoge bloedstroom in het hart gecombineerd met verschillende 'tissue sinks, " waarmee circulerende cellen in contact komen met, betekent dat het merendeel van de stamcellen in de longen en de milt terechtkomt.
Nutsvoorzieningen, onderzoekers van Bristol's School of Cellular and Molecular Medicine hebben een manier gevonden om dit te overwinnen door stamcellen te modificeren met een speciaal eiwit, zodat ze 'thuis' zijn in hartweefsel.
Dr. Adam Perriman, de hoofdauteur van de studie, universitair hoofddocent biomaterialen, UKRI Future Leaders Fellow en oprichter van het celtherapietechnologiebedrijf CytoSeek, legde uit:"Met regeneratieve celtherapieën, waar u iemand probeert te behandelen na een hartaanval, de cellen gaan zelden naar waar u ze wilt hebben. Ons doel is om deze technologie te gebruiken om het celmembraan opnieuw te ontwerpen, zodat wanneer ze worden geïnjecteerd, ze zullen specifieke weefsels van onze keuze herbergen.
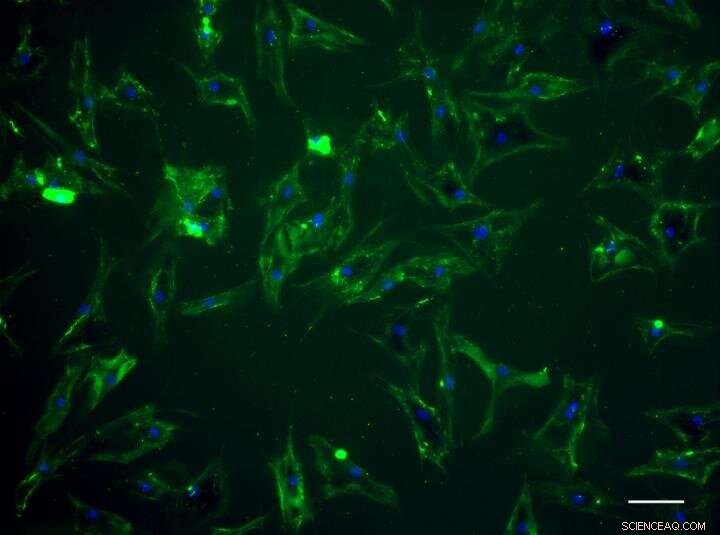
Menselijke mesenchymale stengels vertonen groene fluorescentie nadat ze 'geschilderd' zijn door het designer-eiwit. Krediet:Universiteit van Bristol
"We weten dat sommige bacteriecellen eigenschappen bevatten die ze in staat stellen om ziek weefsel op te sporen en te 'herbergen'. Bijvoorbeeld, de orale bacterie die in onze mond wordt aangetroffen, kan af en toe keelontsteking veroorzaken. Als het in de bloedbaan terechtkomt, kan het 'thuis' naar beschadigd weefsel in het hart en infectieuze endocarditis veroorzaken. Ons doel was om het homing-vermogen van bacteriecellen te repliceren en toe te passen op stamcellen."
Het team ontwikkelde de technologie door te kijken hoe bacteriële cellen een eiwit genaamd adhesine gebruiken om 'thuis' te zijn in hartweefsel. Met behulp van deze theorie, de onderzoekers konden een kunstmatige celmembraanbindende versie van de adhesine maken die op de buitenkant van de stamcellen 'geschilderd' kon worden. In een diermodel, het team kon aantonen dat deze nieuwe celmodificatietechniek werkte door stamcellen in een muis naar het hart te leiden.
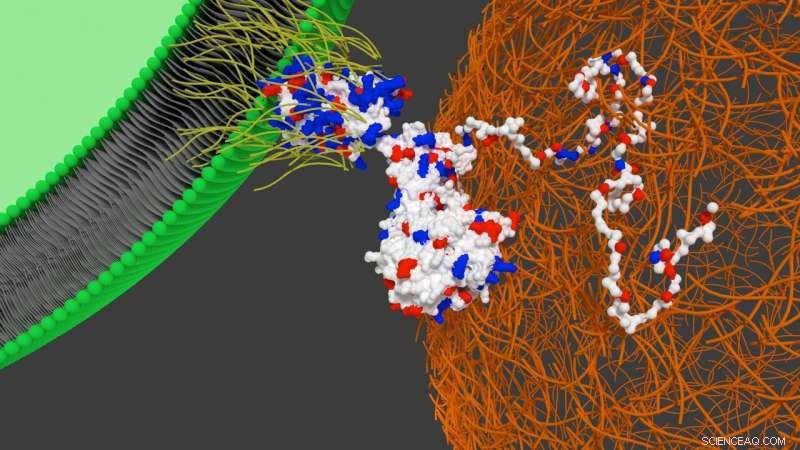
Schematische weergave van de interactie van het designer-eiwit op het oppervlak van de stamcel met hartfibronectine. Krediet:Universiteit van Bristol
Dr. Perriman voegde toe:"Onze bevindingen tonen aan dat de cardiale homing-eigenschappen van infectieuze bacteriën kunnen worden overgedragen op menselijke stamcellen. we laten in een muismodel zien dat het designer-adhesine-eiwit spontaan in het plasmamembraan van de stamcellen wordt ingevoegd zonder cytotoxiciteit, en stuurt vervolgens de gemodificeerde cellen naar het hart na transplantatie. Voor zover we weten, dit is de eerste keer dat de targeting-eigenschappen van infectieuze bacteriën zijn overgebracht naar zoogdiercellen.
"Deze nieuwe techniek heeft een enorm potentieel voor de zeven miljoen mensen die momenteel in het VK met hartaandoeningen leven."
 Tekenen en symptomen van hondsdolheid in eekhoorns
Tekenen en symptomen van hondsdolheid in eekhoorns  In opmerkelijke verschuiving, vier op de vijf Texanen zeggen dat klimaatverandering echt is. Wat nu?
In opmerkelijke verschuiving, vier op de vijf Texanen zeggen dat klimaatverandering echt is. Wat nu? Wat elk land wel en niet kan doen op Antarctica, in naam van de wetenschap
Wat elk land wel en niet kan doen op Antarctica, in naam van de wetenschap Omslagpunt klimaatverandering kan sneller komen dan we denken:studie
Omslagpunt klimaatverandering kan sneller komen dan we denken:studie Dodelijke cycloon snijdt verwoestend pad in India en Bangladesh
Dodelijke cycloon snijdt verwoestend pad in India en Bangladesh
Hoofdlijnen
- Onderzoekers willen weten waarom beluga-walvissen nog niet zijn hersteld
- Luie valsspeler leeft onder de grond,
- Okinawaanse pitadder-genoom onthult evolutie van slangengif
- Wetenschapper duikt in honderden onderwatergrotten op zoek naar nieuwe vormen van leven
- Activisten willen brug over snelweg bouwen om wilde dieren veilig over te steken
- Meer stress en lagere overlevingskansen voor vogels bij jonge, beheerde bossen
- Hoe verbeteren microscopen ons leven vandaag?
- Opnieuw geïntroduceerde buideldieren kunnen een nieuwe bedreiging vormen voor op de grond levende vogels
- Wat is het verschil tussen een protist en een menselijke huidcel?
- Nieuwe technologie kan wetshandhavers helpen kleinere hoeveelheden fentanyl met een hogere mate van nauwkeurigheid te detecteren
- Een 3D-geprinte bioresorbeerbare luchtwegstent maken
- Wetenschapper vindt manier uit om kunstmatige fotosynthese op gang te brengen om lucht te zuiveren

- Onderzoek wijst op tweede kans voor afgewezen antibioticumkandidaat

- Kwantumfysica en origami voor de ultieme beterschapskaart

 Amazon werkt naar verluidt aan een door Alexa aangedreven wearable die menselijke emoties leest
Amazon werkt naar verluidt aan een door Alexa aangedreven wearable die menselijke emoties leest Onze misplaatste angst voor banen stelende robots
Onze misplaatste angst voor banen stelende robots Afbeelding:eerste lichtgegevens voor NASA's Parker Solar Probe
Afbeelding:eerste lichtgegevens voor NASA's Parker Solar Probe Hoe te identificeren haaientanden gevonden in South Carolina
Hoe te identificeren haaientanden gevonden in South Carolina Plan om Indonesische veengebieden te beschermen met luchtkartering wint $ 1 miljoen
Plan om Indonesische veengebieden te beschermen met luchtkartering wint $ 1 miljoen International Space Station passeert Venus en Saturnus
International Space Station passeert Venus en Saturnus CERN:De eerste versnellers zijn weer in actie
CERN:De eerste versnellers zijn weer in actie Onderzoekers stellen nieuwe tijdlijn vast voor oud magnetisch veld op Mars
Onderzoekers stellen nieuwe tijdlijn vast voor oud magnetisch veld op Mars
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

