
Wetenschap
Chemici tonen aan dat het katalytische bereik van enzymen kan worden vergroot
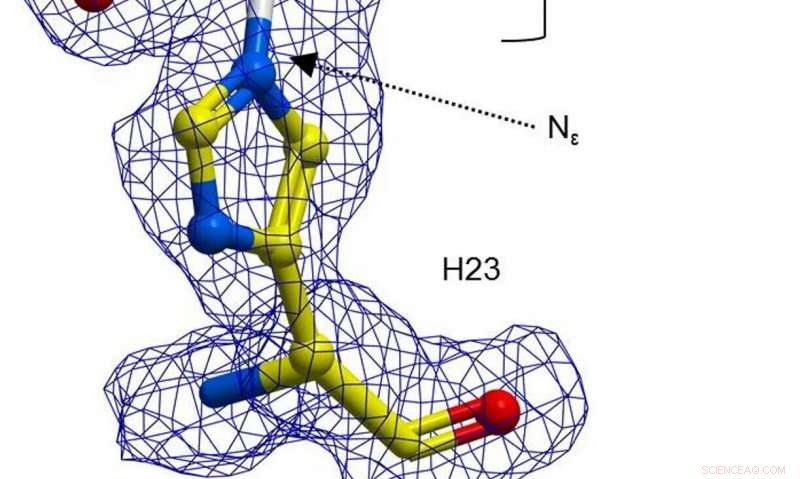
Een bal-en-stok weergave van H23 van BH32 geremd met 2-broomacetofenon, gekleurd door atoomtype met H23-koolstofatomen in geel en acetofenon-koolstofatomen in wit. Duidelijke FEM-elektronendichtheid (blauw, omlijnd op 1σ) strekt zich uit tussen de Nε van H23 en acetofenon. Credit: Natuur (2019). DOI:10.1038/s41586-019-1262-8
Een team van chemici van de Universiteit van Manchester heeft een manier gevonden om een abnormaal residu in een enzym op te nemen om te laten zien hoe het katalytische bereik van enzymen kan worden vergroot. In hun artikel gepubliceerd in het tijdschrift Natuur , de groep beschrijft het uitbreiden van het bereik van katalytische enzymen die kunnen worden gebruikt om een grotere verscheidenheid aan zijketens voor katalyse te verschaffen - door een uitgebreid "alfabet" van aminozuren te gebruiken. Adam Nelson, met de Universiteit van Leeds, heeft een News and Views Research-paper gepubliceerd waarin het werk van het team in hetzelfde tijdschriftnummer wordt besproken.
Zoals Nelson opmerkt, er zijn niet veel natuurlijke aminozuurresten die door enzymen kunnen worden gebruikt om reacties te katalyseren - hij merkt op dat er maar 20 soorten zijn die kunnen worden gebruikt om dergelijke enzymen te bouwen. Dit gebrek aan opties heeft ertoe geleid dat onderzoekers zich afvroegen of het scala aan aminozuren dat door enzymen kan worden gebruikt om meer katalytische reacties mogelijk te maken, kan worden uitgebreid - misschien door gebruik te maken van wat de onderzoekers beschrijven als een "alfabet" van aminozuren die een bredere verschillende zijketens die voor katalyse kunnen worden gebruikt. In deze nieuwe poging de onderzoekers gebruikten zo'n uitgebreid alfabet van aminozuren om het scala aan mogelijkheden uit te breiden. Ze melden dat daarbij ze waren in staat om een enzym te construeren met behulp van leden van een onnatuurlijke katalytische groep en toonden aan dat dit zou kunnen leiden tot verbeteringen met behulp van een benadering die gerichte evolutie wordt genoemd.
In hun werk, de onderzoekers kozen ervoor om een enzym te hermodelleren om er een effectievere katalysator van te maken - ze begonnen met op te merken dat een histidine-aminozuurresidu in het enzym BH32 een intermediaire acyl-enzymverbinding kan vormen. Dat tussenproduct werd gehydrolyseerd om een product van de reactie te maken, maar het resultaat was niet zoals verwacht. Het team gebruikte vervolgens gerichte evolutie om de rol van de Nδ-methylhistidine te optimaliseren. Dat omvatte een aantal benaderingen om mutaties te forceren. Als resultaat, het team ontdekte een variant genaamd OE1.3, waarvan uit testen bleek dat het efficiënter was. Het team ging door met een meer gerichte evolutie en kwam uiteindelijk tot OE1.4 - een enzym dat verbeterde katalytische activiteit vertoonde.
© 2019 Wetenschap X Netwerk
 Sidewinder Snake Facts
Sidewinder Snake Facts National Weather Service annuleert zijn vakbondscontract
National Weather Service annuleert zijn vakbondscontract Post-Abe-agenda:Suga zegt dat Japan tegen 2050 koolstofvrij moet zijn
Post-Abe-agenda:Suga zegt dat Japan tegen 2050 koolstofvrij moet zijn NASA-studie vindt een verband tussen bosbranden en droogte
NASA-studie vindt een verband tussen bosbranden en droogte Onderzoekers vliegen en zeilen naar de meest stormachtige plek op aarde om wolkenprocessen te bestuderen
Onderzoekers vliegen en zeilen naar de meest stormachtige plek op aarde om wolkenprocessen te bestuderen
Hoofdlijnen
- Duplicaties van niet-coderend DNA kunnen de evolutie van mensspecifieke eigenschappen hebben beïnvloed
- Your Brain On: An All Nighter
- Hoe een jetlag werkt
- Beschermde wateren bevorderen de heropleving van de westkust-zeebaars
- Methode om overvloed te schatten, trends in Noord-Atlantische walvissen bevestigen achteruitgang
- Identificatie van een nieuwe familie van op licht reagerende eiwitten
- Is vissen met elektriciteit minder destructief dan de zeebodem opgraven met boomkorren?
- Spanje meldt geval van gekkekoeienziekte
- Forensische wetenschapsprojecten voor middelbare scholieren
- Directe detectie van circulerende tumorcellen in bloedmonsters
- Nieuw covalent organisch raamwerk met boor en fosfor zorgt voor betere connectiviteit
- Temperatuursensor kan helpen bij het beschermen van mRNA-vaccins

- Nieuwe methode voor microbiële energieproductie ontdekt

- Wetenschappers werpen nieuw licht op moleculair gedrag

 Wetenschappers stellen mogelijke mechanismen voor om coronale mini-jets in geactiveerde tornado-achtige prominentie te verklaren
Wetenschappers stellen mogelijke mechanismen voor om coronale mini-jets in geactiveerde tornado-achtige prominentie te verklaren Telescopen werken samen om gigantische melkweg te bestuderen
Telescopen werken samen om gigantische melkweg te bestuderen Dieren in de Himalaya
Dieren in de Himalaya Met nieuwe techniek kunnen onderzoekers de spanning in zonnecellen van de volgende generatie in kaart brengen
Met nieuwe techniek kunnen onderzoekers de spanning in zonnecellen van de volgende generatie in kaart brengen AI-onderzoeker biedt inzicht in belofte, valkuilen van machine learning
AI-onderzoeker biedt inzicht in belofte, valkuilen van machine learning Neemt een likje en blijft maar bewaren
Neemt een likje en blijft maar bewaren Onderzoek moet dodelijke milieurampen met mijnafval voorkomen
Onderzoek moet dodelijke milieurampen met mijnafval voorkomen Kunnen computers helpen om partijdige scheidslijnen te dichten?
Kunnen computers helpen om partijdige scheidslijnen te dichten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

