
Wetenschap
Wetenschappers geven een glimp met hoge resolutie van de enzymstructuur
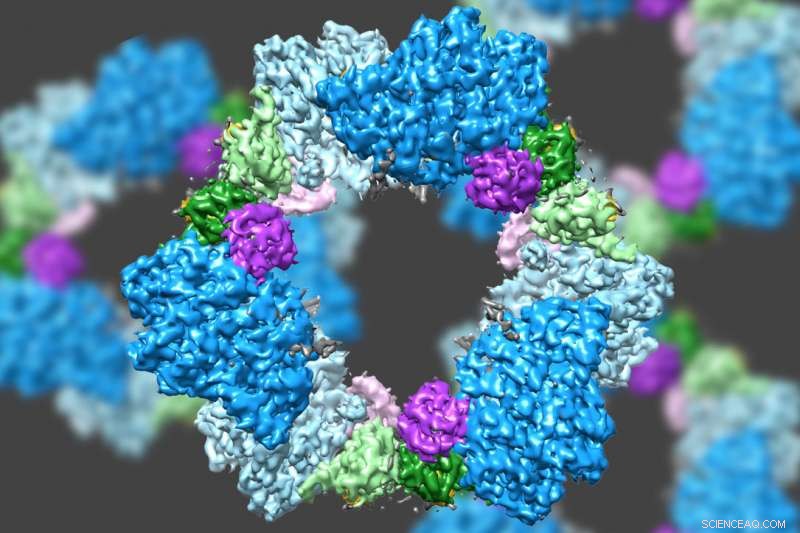
Met behulp van een state-of-the-art type elektronenmicroscopie, een door MIT geleid team heeft de structuur ontdekt van een enzym dat cruciaal is voor het in stand houden van een adequate toevoer van DNA-bouwstenen in menselijke cellen. Krediet:Massachusetts Institute of Technology
Met behulp van een state-of-the-art type elektronenmicroscopie, een door MIT geleid team heeft de structuur ontdekt van een enzym dat cruciaal is voor het in stand houden van een adequate toevoer van DNA-bouwstenen in menselijke cellen.
Hun nieuwe structuur onthult ook het waarschijnlijke mechanisme voor hoe cellen het enzym reguleren, bekend als ribonucleotidereductase (RNR). aanzienlijk, het mechanisme lijkt te verschillen van dat van de bacteriële versie van het enzym, wat suggereert dat het mogelijk zou kunnen zijn om antibiotica te ontwerpen die het bacteriële enzym selectief blokkeren.
"Mensen hebben geprobeerd erachter te komen of er iets anders genoeg is dat je bacteriële enzymen zou kunnen remmen en niet de menselijke versie, " zegt Catherine Drennan, een MIT hoogleraar scheikunde en biologie en een Howard Hughes Medical Institute Investigator. "Door deze sleutelenzymen te overwegen en uit te zoeken wat de verschillen en overeenkomsten zijn, we kunnen zien of er iets in het bacteriële enzym zit dat het doelwit kan zijn van medicijnen met kleine moleculen."
Drennan is een van de senior auteurs van de studie, die verschijnt in het nummer van 20 februari van het tijdschrift eLife . Joanne Stubbe, de Novartis Professor of Chemistry Emerita aan het MIT, en Francisco Asturië, een universitair hoofddocent biochemie aan de University of Colorado School of Medicine, zijn ook senior auteurs. De hoofdauteurs van het artikel zijn MIT-onderzoeker Edward Brignole en voormalig Scripps Research Institute-postdoc Kuang-Lei Tsai, die nu een assistent-professor is aan het University of Texas Houston Medical Center.
Een ongewoon enzym
Het RNR-enzym, die in alle levende cellen wordt aangetroffen, zet ribonucleotiden (de bouwstenen van RNA) om in deoxyribonucleotiden (de bouwstenen van DNA). Cellen moeten een voldoende voorraad van deze bouwstenen aanhouden, maar als ze er te veel verzamelen, RNR wordt afgesloten door een deoxynucleotide-molecuul dat bekend staat als dATP. Als er meer deoxynucleotiden nodig zijn, een verwant molecuul genaamd ATP bindt aan RNR en zet het weer aan.
Een ongebruikelijk kenmerk van RNR is dat het de productie van vier verschillende producten kan katalyseren:de nucleotidebasen, vaak afgekort als A, G, C, en T. In 2016, Drennan ontdekte dat het enzym dit bereikt door van vorm te veranderen als reactie op regulerende moleculen.
Het meeste eerdere werk van de onderzoekers aan de RNR-structuur was gericht op de versie die wordt gevonden in E coli . Voor die onderzoeken ze gebruikten röntgenkristallografie, een techniek die de atomaire en moleculaire structuur van een eiwit kan onthullen nadat het is gekristalliseerd.
In de nieuwe studie Drennan en haar collega's gingen op zoek naar de menselijke versie van RNR. De structuur van dit eiwit, die heel anders bleek te zijn dan de bacteriële versie, bleek ongrijpbaar met behulp van röntgenkristallografie, wat niet goed werkt voor eiwitten die niet gemakkelijk kristalliseren. In plaats daarvan, de onderzoekers wendden zich tot een geavanceerde vorm van microscopie die bekend staat als cryo-elektronenmicroscopie (cryo-EM).
Tot voor kort, cryo-EM bood doorgaans een resolutie van ongeveer 10 tot 20 angstrom, die de algehele vorm van een eiwit zou kunnen onthullen, maar geen detail over de positie en vorm van kleinere structurele eenheden erin. Echter, in de laatste paar jaren, technologische vooruitgang heeft geleid tot een explosie van het aantal structuren met resoluties van ongeveer 3 angstrom. Dat is hoog genoeg om individuele eiwitketens binnen het grotere molecuul te traceren, evenals interne structuren zoals helices en zelfs zijketens van aminozuren.
Wetenschappers wisten al dat RNR bestaat uit twee eiwitsubeenheden die bekend staan als alfa en bèta. Met behulp van cryo-EM, het MIT-team ontdekte dat de menselijke versie van het enzym een ring vormt die is gemaakt van zes van de alfa-subeenheden. Wanneer ATP, die RNR activeert, is gebonden aan het enzym, de ring is onstabiel en kan gemakkelijk worden geopend, waardoor de bèta-subeenheid zijn weg naar de ring kan vinden. Door deze samenvoeging van alfa en bèta kan de actieve plaats van het enzym, gelokaliseerd in de bèta-subeenheid, om de chemische reacties uit te voeren die nodig zijn om deoxynucleotiden te produceren.
Echter, wanneer de remmer dATP aanwezig is, de ring wordt veel stijver en laat de bèta-subeenheid niet toe. Dit voorkomt dat het enzym de productie van deoxynucleotiden katalyseert.
Medicijnen ontwerpen
Verschillende kankermedicijnen die nu in gebruik of in ontwikkeling zijn, richten zich op de menselijke versie van RNR, interfereren met het vermogen van kankercellen om zich voort te planten door hun toevoer van DNA-bouwstenen te beperken. Het MIT-team heeft bewijs gevonden dat ten minste één van deze medicijnen, clofarabine difosfaat, werkt door de vorming van stijve 6-eenheid alfa-ringen te induceren.
Deze ring met 6 eenheden wordt niet gevonden in de bacteriële vorm van RNR, die in plaats daarvan assembleert tot een afzonderlijke ring met vier alfa-subeenheden en vier bèta-subeenheden. Dit betekent dat het mogelijk zou kunnen zijn om antibiotica te ontwerpen die gericht zijn op de bacteriële versie, maar niet op de menselijke versie. zegt Drennan.
Ze is nu van plan de structuren te onderzoeken van andere eiwitmoleculen die moeilijk te bestuderen zijn met röntgenkristallografie, inclusief eiwitten met ijzerzwavelclusters, die in veel metabole routes worden gevonden. Het microscopiewerk in deze studie werd uitgevoerd bij het Scripps Research Institute, maar wanneer het nieuwe MIT.nano-gebouw van MIT wordt geopend, het zal twee cryo-EM-microscopen huisvesten die beschikbaar zullen zijn voor de MIT-gemeenschap en andere potentiële gebruikers in de industrie en de academische wereld.
"De technologische vooruitgang die cryo-EM in staat heeft gesteld om zo'n hoge resolutie te bereiken, is echt opwindend, " zegt Drennan. "Het begint echt een revolutie teweeg te brengen in de studie van biologie."
 Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken
Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken Wetenschappers werken aan het maken van microchip-elementen van moleculaire grootte
Wetenschappers werken aan het maken van microchip-elementen van moleculaire grootte Wat is het doel van een pipet?
Wat is het doel van een pipet?  Wolfraamsuboxide verbetert de efficiëntie van platina bij de productie van waterstof
Wolfraamsuboxide verbetert de efficiëntie van platina bij de productie van waterstof Nobelprijswinnende techniek zoals Google Earth voor moleculen
Nobelprijswinnende techniek zoals Google Earth voor moleculen
Hoofdlijnen
- Het publiek is minder bang voor haaien als ze hun gedrag begrijpen
- Dit is waarom je duurzame tonijn ook onhoudbaar is
- Reflecteert Saturnus licht?
- Wat gebeurt er met een cel als het DNA-chromosomen niet kopieert voordat het zich splitst?
- De effecten van ultraviolette straling op gist
- Waar komt de kleur vandaan in paarse kool?
- Twee Caribische vogelvangbomen vernoemd naar twee vrouwen met over het hoofd gezien botanische werken
- Wetenschappers dringen aan op bedreigde lijst van cheeta's
- Hoe een model te maken Plant & Dierlijke cel
- Wetenschappers automatiseren de analyse van de elektrolytsamenstelling voor de productie van aluminium

- Veiliger maandverband gemaakt van palmzetmeel
- Hoe receptoren voor medicijnen in cellen werken
- Nieuw gesynthetiseerde schimmelverbinding kan een zelfvernietigingsknop voor kanker inschakelen
- Zodra we de CO2-uitstoot kunnen opvangen, dit is wat we ermee kunnen doen
 10 dingen die je niet wist over Einstein
10 dingen die je niet wist over Einstein  Enquête beschrijft de impact van de droogte van 2016 op de landbouw in New York
Enquête beschrijft de impact van de droogte van 2016 op de landbouw in New York Opkomst van een nieuwe heteronanostructuurbibliotheek
Opkomst van een nieuwe heteronanostructuurbibliotheek Ultrasnelle sondering onthult ingewikkelde dynamiek van kwantumcoherentie
Ultrasnelle sondering onthult ingewikkelde dynamiek van kwantumcoherentie Hoe Polarity
Hoe Polarity Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren
Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren Zweetgelijkheid:gebruik van campusrecreatie leidt tot academische prestaties en retentie, studie zegt:
Zweetgelijkheid:gebruik van campusrecreatie leidt tot academische prestaties en retentie, studie zegt: Onconventionele kwantumsystemen kunnen leiden tot nieuwe optische apparaten
Onconventionele kwantumsystemen kunnen leiden tot nieuwe optische apparaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Portuguese | Swedish | German | Dutch | Danish | Norway | Spanish |

-
Wetenschap © https://nl.scienceaq.com

