
Wetenschap
Kernelektrontopologieën in chemische binding
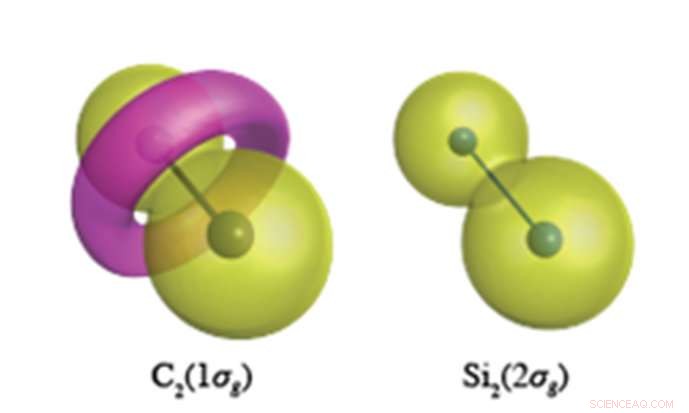
Van binnenste kernelektronen wordt verwacht dat ze een pinda-achtige golffunctie hebben, zoals wordt getoond voor Si 2 s elektronen (rechts). In de C-C binding, echter, de C1s-elektronen vormen een torusachtig kenmerk van tegengestelde polariteit, weergegeven in roze in de linker figuur. Krediet:Yokohama National University
YNU-onderzoekers hebben het eeuwenoude mysterie opgelost waarom silicium de koolstof in organische verbindingen niet kan vervangen. Een nieuwe benchmark kwantumchemische berekening van C 2 , Si 2 , en hun hydriden onthullen een kwalitatief verschil in de topologieën van kernelektron-orbitalen van organische moleculen en hun siliciumanalogen. De onderzoekers stellen andere elementen voor met de neiging van koolstof om hun kernelektronenknoopstructuren te hervormen na chemische binding.
Sinds de ontdekking van silicium en het succes van Wöhler in het midden van de 19e eeuw met het synthetiseren van organische verbindingen, Wöhler was zelf een van de eersten die voorstelde om koolstof in organische verbindingen te vervangen door silicium. In het begin van de 20e eeuw werd duidelijk dat silicium geen chemie heeft die vergelijkbaar is met koolstof, en dromen over op silicium gebaseerd leven overleven alleen in sciencefiction. We weten empirisch dat koolstof het vermogen heeft om een verscheidenheid aan onverzadigde verbindingen te vormen, wat silicium niet doet. Echter, de oorzaak waarom alleen koolstof dit vermogen heeft, is een mysterie gebleven.
Kwantumchemische berekeningen met ongekende nauwkeurigheid, uitgevoerd bij YNU, onthullen dat kernelektronen (die niet verondersteld werden deel te nemen aan chemische binding) een heel andere rol spelen in de onverzadigde verbindingen van koolstof en silicium. Koolstof heeft de neiging om de topologie (knoopstructuur) van zijn kernelektronen te veranderen, die, voor C 2 , resulteert in de vorming van een torusachtige ring in de 1σg orbitaal gevormd door C1s-elektronen (zie figuur). Si 2 , echter, handhaaft de bolvormige kernorbitalen gecentreerd op elke atoomplaats in al zijn moleculen. Door deze flexibiliteit van de kernorbitalen van koolstof kan koolstof een overvloed aan verschillende valentiebindingsstructuren vormen, terwijl silicium beperkt is tot bindingsstructuren die orthogonaal zijn ten opzichte van de atomaire sferische kernorbitalen.
De impact van deze ontdekking is verstrekkend. Kernelektronen zijn tot nu toe min of meer inert aangenomen, maar misschien wordt het nodig om hun bijdrage aan chemische binding opnieuw te beoordelen - althans in het geval van onverzadigde bindingen. Eindelijk, de studie suggereert dat andere elementen, zoals stikstof, fosfor, en fluor, vergelijkbare flexibiliteit vertonen om hun kernelektrontopologieën te wijzigen, en daarom, vergelijkbare rijke chemie vertonen.
De krant, "Core Electron Topologies in Chemical Compounds:Case Study van koolstof versus silicium, " is gepubliceerd in Internationale editie van Angewandte Chemie vol 57(24) op 6 juni, 2018.
 Kleine kooien kunnen vaccins veilig houden bij hoge temperaturen
Kleine kooien kunnen vaccins veilig houden bij hoge temperaturen Nieuwe techniek kan de productie van afval naar methaan versnellen
Nieuwe techniek kan de productie van afval naar methaan versnellen Team ontwikkelt innovatieve, ideale vloeistofafstotende oppervlakken
Team ontwikkelt innovatieve, ideale vloeistofafstotende oppervlakken Elektrochemische synthese van formiaat uit koolstofdioxide met behulp van een tin/gereduceerde grafeenoxidekatalysator
Elektrochemische synthese van formiaat uit koolstofdioxide met behulp van een tin/gereduceerde grafeenoxidekatalysator Wanneer meer botvormende cellen gelijk zijn aan minder bot
Wanneer meer botvormende cellen gelijk zijn aan minder bot
 Wat is de warmste tijd van de dag?
Wat is de warmste tijd van de dag?  Monitoring lavameerniveaus in Congo-vulkaan
Monitoring lavameerniveaus in Congo-vulkaan De toekomst biedt uitdagingen en kansen voor zuivelproducenten
De toekomst biedt uitdagingen en kansen voor zuivelproducenten Afnemende aandacht voor klimaatverandering te midden van pandemie kan blijvende gevolgen hebben
Afnemende aandacht voor klimaatverandering te midden van pandemie kan blijvende gevolgen hebben Na netto nul, we zullen veel verder moeten gaan en historische emissies opruimen
Na netto nul, we zullen veel verder moeten gaan en historische emissies opruimen
Hoofdlijnen
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- Wat hebben piranha's en goudvissen gemeen?
- 5 mensen die niet begraven kunnen blijven
- Appelbomen dragen meer fruit als ze omringd zijn door goede buren
- Dierenartsen waarschuwen dat antivries giftig is voor huisdieren en mensen
- G2-fase: wat gebeurt er in deze subfase van de celcyclus?
- DNA-bewijs zet neushoornstropers achter tralies, studie toont
- Wat doet de DNA-nucleotide volgorde code voor?
- Eerste inzicht in de architectuur van virale filamenten in het Rift Valley Fever-virus
- Boomschors en compost omzetten in vliegtuigvleugels en plastic zakken

- Moleculen uit moedermelk en zeewier suggereren strategieën voor het beheersen van norovirus
- efficiënt, stabiele thermo-elektrische module op basis van hoogwaardige vloeistofachtige materialen

- Een metaalvrije, duurzame benadering van CO2-reductie
- Onderzoekers vinden veelbelovende kandidaten voor nanodeeltjes voor het afvangen en omzetten van koolstofdioxide

 Richt zich op het terugdringen van wapencriminaliteit
Richt zich op het terugdringen van wapencriminaliteit Je kunt eindelijk Mario Kart op je smartphone spelen
Je kunt eindelijk Mario Kart op je smartphone spelen Mechanische barrières voor communicatie
Mechanische barrières voor communicatie Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen
Malariaparasiet verpakt genetisch materiaal voor reis van muggen naar mensen Waarom buitenaardse intelligentie eerder kunstmatig dan biologisch is
Waarom buitenaardse intelligentie eerder kunstmatig dan biologisch is Lange- en kortetermijneffecten van opwarming van de aarde
Lange- en kortetermijneffecten van opwarming van de aarde  Kleine nanokristallen scheppen een betere toekomst voor tv-kijkers, studie vondsten
Kleine nanokristallen scheppen een betere toekomst voor tv-kijkers, studie vondsten Nepnieuws over vulkaanuitbarstingen kan levens in gevaar brengen
Nepnieuws over vulkaanuitbarstingen kan levens in gevaar brengen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

