
Wetenschap
Röntgenlaserwetenschappers ontwikkelen een nieuwe manier om te zien hoe bacteriën antibiotica aanvallen

Het experiment werd uitgevoerd met het Coherent X-ray Imaging (CXI) instrument, die gebruik maakt van de snelle, briljante röntgenpulsen van de Linac Coherent Light Source. CXI past de "diffraction-before-destruction"-methode toe om metingen te doen met ultrakorte röntgenpulsen voordat ze hun doelen beschadigen. Krediet:SLAC National Accelerator Laboratory
Tuberculose, een longziekte die zich in de lucht verspreidt door hoesten of niezen, doodt nu wereldwijd meer mensen dan enig ander infectieus agens, volgens het laatste wereldwijde tuberculoserapport van de Wereldgezondheidsorganisatie. En in honderdduizenden gevallen per jaar, behandeling mislukt omdat de bacteriën die Tb veroorzaken resistent zijn geworden tegen antibiotica.
Nu heeft een internationaal team van onderzoekers een nieuwe manier gevonden om te onderzoeken hoe Tb-bacteriën een belangrijke familie van antibiotica inactiveren:ze zagen het proces voor het eerst in actie met behulp van een röntgenvrije-elektronenlaser, of XFEL.
In experimenten bij het SLAC National Accelerator Laboratory van het Department of Energy, ze hebben een antibioticum gemengd met een enzym dat bètalactamase wordt genoemd en dat door Tb-bacteriën wordt gebruikt, en keek toen in realtime hoe het enzym het antibioticum aanviel om het te deactiveren.
De methode van de onderzoekers, genaamd mix-and-inject seriële kristallografie, maakt gebruik van de briljante, ultrasnelle pulsen geproduceerd door SLAC's Linac Coherent Light Source (LCLS). Röntgenfoto's genomen 30 milliseconden tot 2 seconden nadat de reactie begon, toonden lactamasebinding aan het antibioticum, ceftriaxon, en het barsten van een van zijn chemische bindingen.
De resultaten van het experiment zijn vandaag gepubliceerd in BMC Biologie .
"Deze proof-of-concept-studie laat zien dat we tijdens het proces de vorm en tussenstadia van de moleculen kunnen zien, " zegt Marius Schmidt, een professor aan de Universiteit van Wisconsin in Milwaukee die het experiment leidde. "Na tientallen jaren andere technieken op het gebied van kristallografie te hebben geprobeerd, de technologie is er."
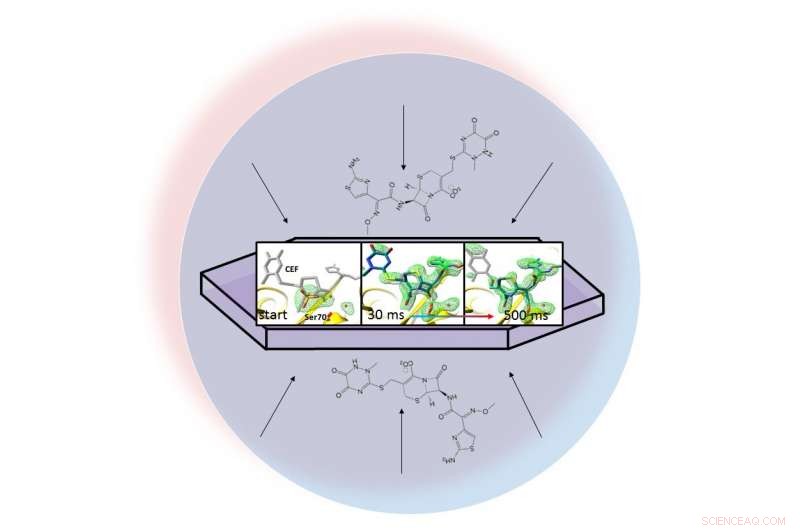
In een vloeistofdruppel (weergegeven door de lichtblauwe cirkel), een antibioticum verspreidt zich door een gekristalliseerd eiwit, bèta-lactamase, en bindt eraan. Met röntgenfoto's van het gebonden paar konden onderzoekers kaarten maken van de elektronendichtheid (groen) en een ring in het antibioticum zien openbreken (uiterst rechts) 30 tot 500 milliseconden nadat de reactie begon. Krediet:Marius Schmidt / Universiteit van Wisconsin Milwaukee
In kristallografie, wetenschappers vormen een kristal uit vele kopieën van een eiwit en raken het kristal met röntgenstralen om een diffractiepatroon op een detector te produceren, die de atomaire structuur van het eiwit onthult. Deze structuur is essentieel om te begrijpen hoe enzymen en andere eiwitten werken.
In het verleden werkte dit alleen met relatief grote kristallen, die bij deze methode een beperkte waarde hebben omdat de oplossing die het antibioticum bevat er lang over zou doen om in het kristal te diffunderen en met het enzym te reageren. Het is belangrijk dat de diffusie sneller is dan de reactie, zodat de vele eiwitmoleculen in het kristal samen het chemische proces starten.
Maar LCLS en andere XFEL's hebben zulke intense stralen dat ze diffractiepatronen van veel kleinere kristallen kunnen vastleggen, een miljoenste van een meter breed of minder, Schmidt zei, zodat het antibioticum snel bij het enzym kan komen, en de reactie kan worden vastgelegd met röntgenstralen.
"Hoewel er elegante studies zijn geweest om eiwitbewegingen te observeren met door licht veroorzaakte veranderingen, ons werk illustreert dat een grotere klasse van eiwitten, namelijk enzymen, kan op een tijdsopgeloste manier worden onderzocht bij LCLS en andere XFEL's, " zegt José Olmos, een doctoraatsstudent aan de Rice University die een van de belangrijkste auteurs van de publicatie is.
In dit onderzoek, het onderzoeksteam leverde minuscule kristallen van bèta-lactamase terwijl ze werden gemengd met het antibioticum, slechts fracties van een seconde voordat ze werden geraakt met röntgenpulsen.
Krediet:CC0 Publiek Domein
Het team nam tijdens de reactie miljoenen röntgenfoto's en hechtte ze aan elkaar om een kaart te maken die veranderingen in de driedimensionale structuur van het antibioticum laat zien terwijl het bij kamertemperatuur met het enzym interageert.
"Voor structurele biologen, zo leren we precies hoe biologie functioneert, " zegt Mark Hunter, stafwetenschapper bij SLAC en co-auteur van het onderzoek. "We ontcijferen de structuur van een molecuul op een bepaald moment, en het geeft ons een beter idee van hoe het molecuul werkt."
In toekomstige experimenten, het nemen van nog meer snapshots tijdens de reactie zou meer details kunnen opleveren over de structuur en het chemische gedrag van lactamase. Met meer informatie zouden wetenschappers het ontwerp van antibiotica kunnen manipuleren om dergelijke aanvallen te voorkomen. De experimentele methode kan ook worden toegepast om de fijne details te leren van andere soorten biologische processen waarbij enzymen reacties initiëren of sturen.
"Er is veel opwinding over deze methode, omdat het dit nieuwe tijdsrijk opent voor structurele biologen, Hunter zegt. Eerder werk met deze techniek legde het omdraaien van een RNA-schakelaar vast, " belangrijk voor studies naar retrovirussen en kanker.
De wetenschappers zijn van plan om de methode te gebruiken om naar aanvullende antibiotica te kijken. Ze zijn ook van plan te profiteren van hogere herhalingsfrequenties - sneller afvuren van röntgenpulsen - die worden verwacht bij een toekomstige upgrade naar LCLS en bij de onlangs geopende Europese XFEL. Hierdoor kunnen wetenschappers de gegevens die ze nodig hebben in slechts enkele minuten vastleggen, vergeleken met dagen. Ze zouden ook meer gespreide snapshots van de reacties kunnen maken, wat een nog completer beeld zou kunnen geven van de snelle chemie zoals die gebeurt.
 Kunstmatige intelligentie kan helpen om eerder onoplosbare moordzaken op te lossen
Kunstmatige intelligentie kan helpen om eerder onoplosbare moordzaken op te lossen Nieuwe techniek werpt licht op de mysteries van complexe chemische reactienetwerken
Nieuwe techniek werpt licht op de mysteries van complexe chemische reactienetwerken Staatsonderzoekers Sam Houston bestuderen DNA van explosieven
Staatsonderzoekers Sam Houston bestuderen DNA van explosieven Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie
Moleculaire oriëntatie onderzoeken door polarisatie-selectieve transiënte absorptiespectroscopie Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren
Opvallen:ongebruikelijke magnetische overgang in perovskietoxide kan spintronica helpen stimuleren
 Wat is BPA,
Wat is BPA,  Studie onderzoekt de ecologische voetafdruk van Californische melkkoeien over een periode van 50 jaar
Studie onderzoekt de ecologische voetafdruk van Californische melkkoeien over een periode van 50 jaar Hoe Californië de terugdraaiing van het milieu van Trump blijft blokkeren
Hoe Californië de terugdraaiing van het milieu van Trump blijft blokkeren Effectiviteit op lange termijn van beheerde bosbranden bij herstelwerkzaamheden
Effectiviteit op lange termijn van beheerde bosbranden bij herstelwerkzaamheden Alles op tafel:onderzoekers pleiten voor een uitgebreidere beoordeling van het wereldwijde voedselsysteem
Alles op tafel:onderzoekers pleiten voor een uitgebreidere beoordeling van het wereldwijde voedselsysteem
Hoofdlijnen
- Ongebreidelde consumptie van nijlpaardentanden in combinatie met onvolledige handelsrecords brengen bedreigde nijlpaarden in gevaar
- Waarom blozen mensen?
- 10 misvattingen over de griep
- Welke organismen voeren fotosynthese uit?
- In populaties van microben, bio-ingenieurs vinden een balans tussen tegengestelde genomische krachten
- Wetenschappers identificeren het verband tussen licht en chloroplastontwikkeling
- Uitwerpselen van verstrikte Noord-Atlantische walvissen onthullen torenhoge stressniveaus
- Hoe bacteriën werken
- Celfysiologie: een overzicht van structuur, functie en gedrag
- Na twee uur, zonnebrandcrème met zinkoxide verliest effectiviteit, wordt giftig:studeren

- Team ontwikkelt opvouwbare en wasbare lichtgevende film

- Bestudeer polyfarmacologie eerder in medicijnontdekking, zeggen onderzoekers
- Onderzoekers onthullen in-situ manipulatie van actieve goud-titaniumdioxide-interface

- Zichtbaar licht en nanodeeltjeskatalysatoren produceren gewenste bioactieve moleculen

 De temperatuurstructuur van circumstellaire schijven afleiden uit gepolariseerde emissie
De temperatuurstructuur van circumstellaire schijven afleiden uit gepolariseerde emissie Hoe de vierkantswortel te vinden door afronding naar de dichtstbijzijnde tiende
Hoe de vierkantswortel te vinden door afronding naar de dichtstbijzijnde tiende  Nieuwe benadering van informatieoverdracht bereikt kwantumsnelheidslimiet
Nieuwe benadering van informatieoverdracht bereikt kwantumsnelheidslimiet Houtalternatieven vinden voor bedreigde ebbenhout
Houtalternatieven vinden voor bedreigde ebbenhout Numerieke simulaties van trekproeven van rode bloedcellen
Numerieke simulaties van trekproeven van rode bloedcellen Facebook klaagt Zuid-Koreaans data-analysebedrijf aan
Facebook klaagt Zuid-Koreaans data-analysebedrijf aan Kleurpixels gemaakt van nanodraden bieden een nieuw paradigma voor digitale camera's
Kleurpixels gemaakt van nanodraden bieden een nieuw paradigma voor digitale camera's Wetgever uit Massachusetts wil officiële staatsdinosaurus noemen
Wetgever uit Massachusetts wil officiële staatsdinosaurus noemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

