
Wetenschap
Onderzoekers ontdekken hoe lichaamstemperatuur potentiële knokkelkoorts vernietigt, Zika-vaccin
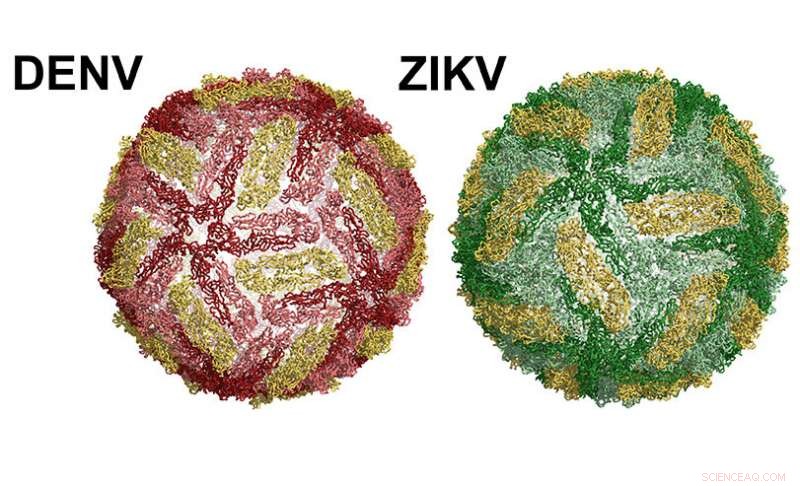
Links een Dengue-virusdeeltje. Rechts Zika. Krediet:UNC School of Medicine
Een belangrijke route naar het creëren van effectieve vaccins tegen dengue-virus en Zika is het E-eiwit dat het oppervlak van elk viraal deeltje bedekt. Als we sterke antistoffen tegen dit E-eiwit zouden kunnen ontwikkelen, dan zou dat de kern zijn van een formidabel vaccin - gebaseerd op het belangrijke feit dat de 180 E-eiwitten in paren voorkomen. Maar het maken van zo'n vaccin is om een aantal redenen moeilijk gebleken. Nu hebben onderzoekers van de UNC School of Medicine de details van een belangrijke barrière voor een veelbelovend vaccin in kaart gebracht. Het is iets dat we allemaal hebben:een natuurlijke lichaamstemperatuur van ongeveer 98,6 graden.
Eerdere studies in het laboratorium van Aravinda de Silva hebben aangetoond dat mensen sterke antilichamen tegen het E-eiwit aanmaken op het virusoppervlak, wat suggereert dat een oplosbare versie van het E-eiwit (sRecE genaamd) een goed vaccin zou kunnen zijn. Helaas, tot nu toe is dit niet uitgekomen, en vaccins op basis van sRecE hebben gefaald. UNC-onderzoekers onder leiding van Brian Kuhlman, doctoraat, hoogleraar biochemie en biofysica, en Avinda de Silva, doctoraat, hoogleraar microbiologie en immunologie, hebben aangetoond dat lichaamstemperatuur de neiging tot paren van sRecE en het vermogen ervan om door deze sterke antilichamen te worden herkend, vermindert.
Deze bevindingen, gepubliceerd in de Tijdschrift voor biologische chemie , suggereren dat het stabiliseren van de koppelingsneiging van sRecE van cruciaal belang kan zijn voor het creëren van een effectief vaccin.
"We hebben laten zien hoe onze natuurlijke lichaamstemperatuur sRecE-potentie ondermijnt en hoe toekomstige op sRecE gebaseerde vaccinontwikkeling vanaf het begin rekening moet houden met temperatuur, " zei UNC-afgestudeerde student Stephan Kudlacek, de eerste auteur op de JBC papier.
Na decennia van intensief onderzoek, dengue- en Zika-virusvaccinontwikkeling heeft beperkt succes gehad. Deze door muggen overgebrachte flavivirussen vormen een groot probleem voor de volksgezondheid. Meer dan 50 procent van de wereldbevolking loopt risico op infectie, honderden miljoenen mensen zijn besmet, en een groot percentage van hen wordt geconfronteerd met ernstige, slopende symptomen. Dengue-infectie kan leiden tot levensbedreigende hemorragische ziekte. In de tussentijd, de recente Zika-uitbraak heeft Zika-infectie in verband gebracht met ernstige neurologische aandoeningen, zoals microcefalie bij zuigelingen en het Guillain-Barré-syndroom bij volwassenen. Om deze redenen, de ontwikkeling van vaccins is opgevoerd om bescherming te bieden tegen zowel dengue als zika.
Vaccinontwikkeling is een uitdaging omdat er vier verschillende serotypes of "smaken" van dengue zijn, en een vaccin moet tegen elk van hen gelijke bescherming bieden. Ook, een vaccin moet zo worden gemaakt dat het het immuunsysteem niet stimuleert om antilichamen aan te maken die het virus herkennen, maar niet kunnen neutraliseren. Als dat gebeurt, dengue en Zika kunnen deze antilichamen gebruiken om cellen van het immuunsysteem te infecteren en de infectie ernstiger te maken - dit wordt antilichaamafhankelijke versterking genoemd.
Dit inherente probleem is de reden waarom Dengvaxia - het enige goedgekeurde vaccin tegen dengue - nu alleen wordt aanbevolen voor gebruik bij mensen met gedeeltelijke immuniteit tegen dengue die zijn verkregen door een eerdere dengue-infectie, omdat het vaccin het risico op ernstige ziekte lijkt te verhogen bij gebruik bij mensen die nooit aan het virus zijn blootgesteld, en het vaccin biedt gedeeltelijke bescherming tussen de verschillende dengue-serotypen.
Het oppervlak van dengue- en Zika-virusdeeltjes zijn structureel vergelijkbaar. Beide virussen zijn omhuld met een enkel eiwit, het envelop (E)-eiwit. Elk virus bevat 180 kopieën van het E-eiwit op het oppervlak, in paren van twee, bekend als homodimeren. Een oplosbare versie van het E-eiwit, genaamd sRecE, kan dezelfde homodimeerstructuur vormen die wordt waargenomen door E-eiwitten op het oppervlak van het virus. Met dengue en zika geïnfecteerde patiënten ontwikkelen neutraliserende en beschermende antilichamen die zich richten op specifieke regio's van het E-eiwit, epitopen genaamd. Deze kennis heeft ertoe geleid dat onderzoekers hebben getest of het E-eiwit of sRecE als effectieve vaccins kan dienen. Helaas, Op sRecE gebaseerde vaccins hebben slecht gepresteerd.
Andere onderzoekers hebben ontdekt dat veel van de krachtigste neutraliserende antilichamen die zijn geïsoleerd uit menselijke patiënten, binden aan epitopen die aanwezig zijn op het E-eiwithomodimeer op het oppervlak van het virus, terwijl de zwak neutraliserende antilichamen die ziekteversterking bevorderen, binden aan een plaats op het E-eiwitmonomeer - een enkele kopie van het E-eiwit, bekend als de fusielus. Een bepaalde klasse van de krachtige antilichamen die de E Dimer Epitoop (EDE) antilichamen worden genoemd, herkent opvallend een regio van het E-eiwit in zowel dengue als Zika. Deze antilichamen zijn in staat om alle vier dengue-serotypen en Zika te neutraliseren. Deze ontdekkingen suggereren dat om effectieve vaccins te maken, het zal belangrijk zijn om antigenen te manipuleren die deze nieuw ontdekte dimeerepitopen presenteren.
Dimeer-specifieke epitopen zouden de meest rechttoe rechtaan soort kunnen zijn om te creëren, bij gebruik van recombinante eiwitten zoals sRecE. En er is voorgesteld dat sRecE-homodimeren kunnen functioneren als effectieve vaccins.
Maar studies hebben gesuggereerd dat onze natuurlijke lichaamstemperatuur van 98,6 graden het vermogen van het E-eiwit om te paren en homodimeren te vormen op het virusoppervlak verandert. Aangezien sRecE een veelbelovend antigeen is voor de ontwikkeling van vaccins, en aangezien de stabiliteit van het sRecE-homodimeer belangrijk is voor het presenteren van dimeer-antilichaamepitopen zoals het EDE voor vaccinatie, De laboratoria van Kuhlman en de Silva probeerden te begrijpen hoe temperatuur de stabiliteit van het sRecE-eiwit en zijn vermogen om homodimeren te vormen, beïnvloedt.
"We hebben een aantal biofysische technieken gebruikt om deze vragen te beantwoorden." zei Kudlacek. "Zoals gewoonlijk wordt waargenomen, we ontdekten dat koudere temperaturen helpen om eiwitten in hun oorspronkelijke of actieve structuur te houden. Daarom, we hebben vervolgens getest om te zien hoe sRecE van drie dengue-serotypen en in Zika homodimeren kan vormen, zoals te zien op het oppervlak van het virus, in buffer bij kamertemperatuur."
De UNC-onderzoekers ontdekten dat dengue en Zika sRecE bij kamertemperatuur wel homodimeren vormen. "Maar toen we het experiment deden bij fysiologische temperatuur [98?F], alle sRecE's - inclusief dengue serotype 2 (DENV2) en Zika sRecE homodimeren - vielen uit elkaar en werden monomeren. Dit resultaat toonde aan dat de fysiologische temperatuurgeïnduceerde E-eiwitveranderingen die op het virusoppervlak worden waargenomen, ook voorkomen in de sRecE. homodimeren bij kamertemperatuur.
De onderzoekers vroegen zich toen af:aangezien sRecE-dimerisatie wordt verminderd bij fysiologische temperatuur, zijn antilichamen die specifiek het E-dimeer herkennen in staat om te binden aan dengue en Zika sRecE bij fysiologische temperatuur? Ze testten dit en ontdekten dat de dengue en Zika sRecE homodimeren uit elkaar vielen bij 98,6F, waardoor de dimeerepitopen die aanwezig zijn in het sRecE-homodimeer worden geëlimineerd en antilichaambinding wordt verminderd.
"Onze resultaten laten zien dat, op lichaamstemperatuur, de aanwezigheid van dengue en Zika sRecE homodimeren is sterk verminderd, en de aanwezigheid van sRecE-monomeer wordt verhoogd, " zei Kudlacek. "Dit geeft een verklaring waarom eerdere op sRecE gebaseerde vaccinstrategieën slecht hebben gepresteerd, aangezien lichaamstemperatuur de voorkeur geeft aan monomeer sRecE, waardoor het immuunsysteem wordt gefocust op het genereren van meer zwak neutraliserende antilichamen, wat kan leiden tot een toename van de ziekte, in plaats van krachtig neutraliserende dimeer-specifieke antilichamen te produceren."
Voor toekomstige op sRecE gebaseerde vaccinontwikkeling, dit werk suggereert dat het sRecE-homodimeer opnieuw moet worden ontworpen om stabiel te zijn bij lichaamstemperatuur, zodat het immuunsysteem E-dimeer-specifieke antilichamen kan genereren die sterk genoeg zijn om te beschermen tegen ziekte in plaats van het te versterken.
 Video:De chemie van het koken van voedsel
Video:De chemie van het koken van voedsel Wat zijn subscripts in een chemische formule die wordt gebruikt om aan te geven?
Wat zijn subscripts in een chemische formule die wordt gebruikt om aan te geven?  Efficiënte bottom-up synthese van nieuw perovskietmateriaal voor de productie van ammoniak
Efficiënte bottom-up synthese van nieuw perovskietmateriaal voor de productie van ammoniak Nederlandse koningin en robot openen 3D-geprinte brug in Amsterdam
Nederlandse koningin en robot openen 3D-geprinte brug in Amsterdam Wetenschappers hebben eetbare films gemaakt voor voedselverpakkingen
Wetenschappers hebben eetbare films gemaakt voor voedselverpakkingen
Hoofdlijnen
- Vier belangrijke soorten chromosomen
- Snelle papegaaien gefokt op roofdiervrije eilanden die met uitsterven worden bedreigd
- Namen van de enzymen in de mond & slokdarm
- Bloed afnemen met de push-pull-methode levert nauwkeurige resultaten op met minder porren
- Wat zijn de purine basen van DNA?
- Soorten organellen
- Chemische stoffen gebruikt in DNA-analyse
- Wat is Serum?
- Hoe telomeren werken
- Slimme spons kan olielekkages opruimen

- Een fatale fout van een batterij overwinnen
- Video:Wat zijn forever chemicaliën, en gaan ze voor altijd mee?

- 100 procent biobased, transparant, en thermisch stabiel polyamide

- Hooggeconcentreerde waterige elektrolyten kunnen de in batterijen gebruikte oplosmiddelen vervangen
 Onderzoekers onderzoeken hoe fouten de geloofwaardigheid van online beoordelingen beïnvloeden
Onderzoekers onderzoeken hoe fouten de geloofwaardigheid van online beoordelingen beïnvloeden Behoud of ontwikkeling? Brazilië Amazon op een kruispunt
Behoud of ontwikkeling? Brazilië Amazon op een kruispunt Nieuw rapport vindt grimmige transitongelijkheid in Baltimore
Nieuw rapport vindt grimmige transitongelijkheid in Baltimore Gevaarlijke verontreinigende stoffen op stortplaatsen gerangschikt in volgorde van toxiciteit
Gevaarlijke verontreinigende stoffen op stortplaatsen gerangschikt in volgorde van toxiciteit Vorige maand was de warmste januari ooit, Amerikaanse wetenschappers zeggen:
Vorige maand was de warmste januari ooit, Amerikaanse wetenschappers zeggen: Specialisten in mechanica onderzochten het gedrag van vacuümolie in de ruimte
Specialisten in mechanica onderzochten het gedrag van vacuümolie in de ruimte Hoe kaarten werken
Hoe kaarten werken  Hoe wordt helium gemaakt?
Hoe wordt helium gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Norway | Italian | Danish |

-
Wetenschap © https://nl.scienceaq.com

