
Wetenschap
Wetenschappers onthullen cryo-elektronenmicroscopiestructuur van een herpesvirus-capside bij 3,1 Angstrom
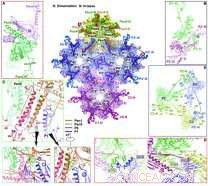
Overzicht van de interacties aan het binnenste capside-oppervlak. Krediet:WANG Xiangxi
Het herpesvirus is genetisch en structureel een van de meest complexe virussen. Het verspreidt zich efficiënt binnen de gastpopulatie, veroorzaakt een reeks ziekten bij de mens, waaronder aangeboren aandoeningen en kankers.
De assemblageroute van herpesvirus produceert drie verschillende soorten capsiden genaamd A-, B- en C-capsiden, respectievelijk. De drie capside-types hebben allemaal volwassen hoekige schelpen en een vergelijkbaar montagemechanisme. Echter, er is weinig bekend over de structuur en het assemblagemechanisme van het herpes simplex virus (HSV) capside.
Met behulp van een combinatie van "blokgebaseerde" reconstructie en nauwkeurige Ewald-bolcorrecties, Prof. WANG Xiangxi, Prof. RAO Zihe en Prof. ZHANG Xinzheng aan het Instituut voor Biofysica van de Chinese Academie van Wetenschappen, samen met collega's van de Hunan Normal University, en de National Institutes for Food and Drug Control, reconstrueerde de 3.1 Å-structuur van het herpes simplex-virus type 2 (HSV-2) B-capside en bouwde het atomaire model, waardoor het begrip van het assemblagemechanisme van de capside wordt uitgebreid. Deze studie is gepubliceerd in Wetenschap .
Als een van de vier belangrijkste structurele lagen, de 125 nm-capside van herpesvirus beschermt niet alleen het virale genoom tegen mechanische en andere schade, maar functioneert ook om het virale genoom vrij te geven in de gastheercelkern tijdens de initiële infectie en om het genoom tijdens de rijping te verpakken.
De onderzoekers ontdekten dat er vier belangrijke conformeren zijn van het belangrijkste capside-eiwit VP5, die opvallende verschillen vertoont in configuratie en wijze van assemblage om uitgebreide intermoleculaire netwerken te vormen.
de triplex, een heterotrimeer samenstel dat tussen hexameren en pentameren past op quasi-drievoudige posities om de capside aan elkaar te cementeren, bestaat uit twee exemplaren van VP23, elk met opmerkelijk verschillende conformaties, en één exemplaar van VP19C. Zes kopieën van het kleine capside-eiwit VP26 vormen een ring aan de bovenkant van de hexon en stabiliseren het capside verder.
Op basis van de capsidestructuur, de onderzoekers stelden een model voor voor de geordende assemblage van de capside met behulp van een triplex en de covalent gekoppelde lasso-driehoek gevormd door drie VP5's. Deze basisassemblage-eenheden clusteren vervolgens in structuren van een hogere orde die voldoen aan de tweevoudige symmetrie en leiden opkomende assemblagetussenproducten naar de juiste T =16-geometrie, waardoor de eerste stappen naar het begrijpen van de drijfveren van assemblage en de basis van de stabiliteit van de capside.
 Giftige verbindingen opsluiten met moleculaire manden
Giftige verbindingen opsluiten met moleculaire manden Drugsbibliothecaris ontdekt nieuwe stof die veelvoorkomende chirurgische complicaties kan dwarsbomen
Drugsbibliothecaris ontdekt nieuwe stof die veelvoorkomende chirurgische complicaties kan dwarsbomen Wat is de functie van een microscoop?
Wat is de functie van een microscoop?  Zeegraszuur en resveratrol voor het eerst geproduceerd door celfabrieken
Zeegraszuur en resveratrol voor het eerst geproduceerd door celfabrieken Oplossen van spanning op het oppervlak van polymeermengsels
Oplossen van spanning op het oppervlak van polymeermengsels
 In het zicht van New York City, een oerbos wordt geconfronteerd met stormen en zeespiegelstijging
In het zicht van New York City, een oerbos wordt geconfronteerd met stormen en zeespiegelstijging Internationale reizigers ervaren de schadelijke effecten van luchtvervuiling
Internationale reizigers ervaren de schadelijke effecten van luchtvervuiling Nieuw voorspellingsmodel zorgt voor het vroegste bewustzijn ooit van overstromingen en droogtes wereldwijd
Nieuw voorspellingsmodel zorgt voor het vroegste bewustzijn ooit van overstromingen en droogtes wereldwijd Koraalrifexperts doen dringende aanbevelingen voor toekomstig onderzoek
Koraalrifexperts doen dringende aanbevelingen voor toekomstig onderzoek Mumbai vreest voor huizen en levens te midden van stijgende zeeën
Mumbai vreest voor huizen en levens te midden van stijgende zeeën
Hoofdlijnen
- Ideeën voor een Sunscreen Science Fair Project
- Synthetische seks in gist belooft veiligere medicijnen voor mensen
- Wat is het Missyplicity-project?
- Hoe groeit schimmel op voedsel?
- Waarom verplaatsen chloroplasten zich in Elodea?
- Onderzoekers identificeren een paar receptoren die essentieel zijn voor de communicatie tussen mannen en vrouwen bij planten
- Het mysterie van pollenbuisgeleiding ontrafelen
- Het belang van het bestuderen van de DNA-genetica van het menselijk geslacht
- Eksters kunnen vriendschappen sluiten met mensen - dit is hoe
- Engineering ECM-achtige vezels met bioactieve zijde voor 3D-celkweek
- Wetenschappers gaan verder met zoeken naar geheugens moleculaire wortels
- Water ruilen voor CO2 kan fracken groener en effectiever maken

- Algemene descriptor zorgt voor vooruitgang in kleurstofchemie
- Een zwaargewicht oplossing voor lichtere gevechtsvoertuigen

 NASA bestudeert kosmische straling om reizigers op grote hoogte te beschermen
NASA bestudeert kosmische straling om reizigers op grote hoogte te beschermen Waarom ozon een uitdaging vormt voor de voedselzekerheid
Waarom ozon een uitdaging vormt voor de voedselzekerheid Het in kaart brengen van diepe riffen levert waardevolle gegevens op voor onderzoekers, natuurbeschermers
Het in kaart brengen van diepe riffen levert waardevolle gegevens op voor onderzoekers, natuurbeschermers Hoe werken eenrichtingsspiegels?
Hoe werken eenrichtingsspiegels?  Hoofdoorzaken van bosbranden aanpakken
Hoofdoorzaken van bosbranden aanpakken Verschil tussen een reisblanco en een veldblanco
Verschil tussen een reisblanco en een veldblanco  Onderzoek onthult hoe bacteriën in groepen communiceren om antibiotica te vermijden
Onderzoek onthult hoe bacteriën in groepen communiceren om antibiotica te vermijden klimaatverandering, bosverlies en branden:wetenschappers leggen uit hoe het Amazonewoud in een vicieuze cirkel zit
klimaatverandering, bosverlies en branden:wetenschappers leggen uit hoe het Amazonewoud in een vicieuze cirkel zit
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

