
Wetenschap
Wetenschappers gaan verder met zoeken naar geheugens moleculaire wortels
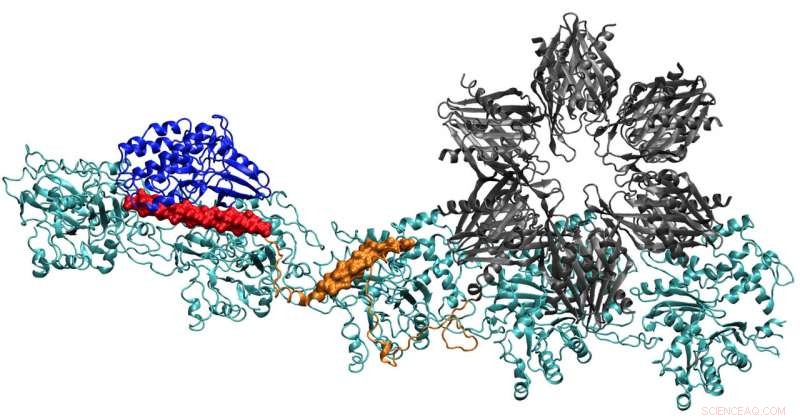
Een model van het CaMKII-eiwit toont meerdere domeinen waarmee het actinefilamenten in de dendrieten van neuronen tot bundels kan binden, de dendrieten hun vorm geven. Onderzoekers van de Rice University, de University of Houston en het University of Texas Health Science Center in Houston geloven dat het complex de sleutel is bij de vorming van langetermijngeheugen. Krediet:Wolynes Research Lab/Rice University
Een nieuw stukje van een moeilijke puzzel - de aard van het geheugen - viel deze week op zijn plaats met een hint naar hoe hersencellen van structuur veranderen wanneer ze iets leren.
Interacties tussen drie bewegende delen:een bindend eiwit, een structureel eiwit en calcium - maken deel uit van het proces waarbij elektrische signalen neurale cellen binnenkomen en de moleculaire structuren hermodelleren waarvan gedacht wordt dat ze cognitie en de opslag van herinneringen mogelijk maken.
Collega's van Rice University, de Universiteit van Houston (UH) en het Health Science Center van de Universiteit van Texas in Houston (UTHealth) combineerden theorieën, simulaties en experimenten om te bepalen hoe een centraal bindend eiwit - calcium-calmoduline-afhankelijk kinase II (CaMKII) - bindt en loslaat van het cytoskelet van een neuron.
Het teamrapport in de Proceedings van de National Academy of Sciences geeft de eerste duidelijke details van hoe de bindingsplaatsen van CaMKII werken om actinefilamenten - het structurele eiwit - uit te lijnen in lange, stijve bundels. De bundels dienen als ondersteunende skeletten van dendritische stekels, puntige uitsteeksels die chemische boodschappen ontvangen via synapsen van andere neuronen.
Peter Wolynes, een theoretisch fysicus bij Rice, lid geworden van een doorlopende samenwerking tussen UH-natuurkundige Margaret Cheung en UTHealth-neurobioloog Neal Waxham die tot doel had te begrijpen hoe signalen hun weg vinden door dendrieten, de vertakkingen op zenuwcellen die informatie tussen cellen doorgeven.
Het vinden van de volledige structuur van CaMKII is te complex gebleken voor röntgenkristallografie, hoewel delen van de structuur bekend waren. In combinatie met de actine waaruit het cytoskelet bestaat, het systeem werd ook het grootste eiwit dat Wolynes en zijn team hebben geanalyseerd via hun voorspellingsprogramma voor de eiwitstructuur, AWSEM.
Toen ze klaar waren, de door de computer voorspelde structuur was een opmerkelijke match voor tweedimensionale elektronenmicroscoopbeelden van Waxham en zijn groep die duidelijk laten zien dat parallelle actinefilamenten bij elkaar worden gehouden, ladderachtig, door sporten van CaMKII.
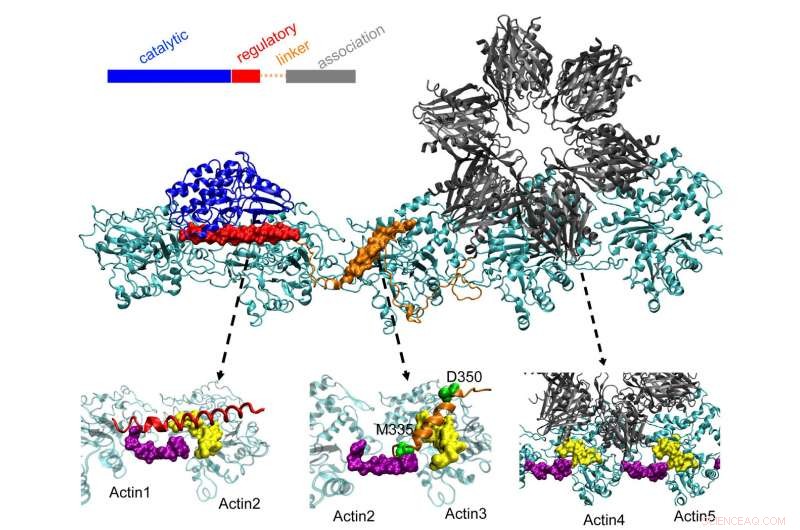
Het CaMKII-eiwit aan de bovenkant dokken in drie zakken op gedraaide actinefilamenten in neuronen, een proces dat onderzoekers van Rice University, de Universiteit van Houston en het Health Science Center van de Universiteit van Texas in Houston (UTHealth) zijn van mening dat het belangrijk is voor het vormen van langetermijngeheugen. Het regulerende domein (rood) op CaMKII bindt ook aan binnenkomende calmoduline-eiwitten, die de hele structuur losmaken van actine en gebundelde filamenten laten reorganiseren. Krediet:Wolynes Research Lab/Rice University
"Er zijn zeker voorbereidende chemische stappen waarbij de enzymactiviteit van CaMKII betrokken is voordat je in dit stadium komt; daarom we hebben geen helemaal duidelijk beeld hoe we alles in elkaar moeten zetten, " zei Wolynes. "Maar het is duidelijk dat de assemblage van het complex de belangrijkste stap is waar chemie verandert in een grotere structuur die een herinnering kan bevatten."
CaMKII is bij uitstek geschikt om te interageren met actine, het meest voorkomende eiwit in eukaryote cellen en een met speciale eigenschappen in neuronen, waar het niet alleen duizenden dendrieten (in elk van miljarden neuronen) hun rustvorm moet geven, maar ze ook een mate van plasticiteit moet geven om zich aan te passen aan een constant spervuur van signalen.
Actinemoleculen assembleren zichzelf tot lange, filamenten draaien. De hydrofobe pockets tussen deze moleculen zijn perfect geconfigureerd om CaMKII te binden, een groot eiwit met meerdere delen, of domeinen. Deze domeinen sluiten aan op drie opeenvolgende bindingsplaatsen op het filament, en de wendingen plaatsen met regelmatige tussenpozen bindingsplaatsen om te voorkomen dat de eiwitten zich opstapelen.
Het "associatie" -domein van CaMKII is een zesvoudige subeenheid die ook bindt aan aangrenzende filamenten om actinebundels te vormen, de ruggengraat van dendritische stekels die deze uitsteeksels hun vorm geven.
Deze bundels blijven stijf als de dendriet weinig calcium bevat. Maar als calciumionen via de synaps binnenkomen, ze combineren met calmoduline-eiwitten, waardoor ze kunnen binden aan een ander deel van CaMKII, het regelgevende domein van de diskette. Dat veroorzaakt de disassociatie van een domein van CaMKII van de gloeidraad, gevolgd door de rest van het eiwit, het openen van een korte tijdspanne waarin de bundels opnieuw kunnen worden geconfigureerd.
"Als er genoeg calcium binnenkomt, het geactiveerde calmoduline breekt deze structuren af, maar slechts voor een tijdje, ' zei Wolynes. 'Dan wordt het cytoskelet hervormd. Gedurende die tijd, de dendritische wervelkolom kan een andere vorm aannemen die misschien groter is."
"We weten dat calcium informatie in de cel brengt, " voegde Cheung toe. "Maar hoe zenuwcellen weten wat ze ermee moeten doen, hangt echt af van hoe dit eiwit informatie codeert. Een deel van ons werk is om dat op moleculair niveau te verbinden en vervolgens te projecteren hoe deze eenvoudige geometrische regels grotere structuren op microschaal ontwikkelen."

Een elektronenmicroscoopbeeld toont actinefilamenten die bij elkaar worden gehouden in parallelle of vertakkende arrangementen door CaMKII-eiwitten in een neuron. Simulaties en experimenten uitgevoerd aan de Rice University, de University of Houston en het University of Texas Health Science Center in Houston toonden aan dat de afstand tussen aangrenzende CaMKII-deeltjes in de complexen bijna vast is op 36 nanometer. De schaalbalk is 100 nanometer. De afbeelding is gemaakt in het Structural Biology Imaging Center van de McGovern Medical School van UTHealth. Krediet:Waxham Lab/UTHealth
De berekeningen van het team toonden aan dat het associatiedomein verantwoordelijk is voor ongeveer 40% van de bindingssterkte van het eiwit aan actine. Een linkerdomein voegt nog eens 40% toe en het cruciale regulerende domein levert de laatste 20% - een verstandige strategie, omdat het regulerende domein op zoek is naar binnenkomende calcium-calmodulines die het hele eiwit van het filament kunnen uitpakken.
Het project kwam tot stand via Rice's Centre for Theoretical Biological Physics (CTBP), waarvan Wolynes mededirecteur is en Cheung senior wetenschapper. Hun associatie gaat terug tot toen beiden aan de Universiteit van Californië waren, San Diego, hij als professor en zij als een afgestudeerde student van rijstfysicus José Onuchic, tevens co-directeur van het CTBP. Wolynes was ook lid van het beoordelingspanel van haar proefschrift, ze zei.
Cheung was op de hoogte van eerder werk van Wolynes en zijn Rice-groep dat suggereerde dat actine prionachtige vezels stabiliseert waarvan gedacht wordt dat ze coderen voor herinneringen in neuronen, en besloot dat het een goede match was voor haar onderzoek met Waxham om te zien hoe calcium CaMKII activeert.
"Dit is een van de meest interessante problemen in de neurowetenschappen:hoe leiden chemische veranderingen op korte termijn tot iets op lange termijn, zoals geheugen?', zei Waxham. 'Ik denk dat een van de meest interessante bijdragen die we leveren is om vast te leggen hoe het systeem veranderingen aanneemt die in milliseconden tot seconden plaatsvinden en iets bouwt dat het initiële signaal kan overleven.'
De puzzel is verre van compleet, zei Wolynes. "Het eerdere werk van Margaret en Neal ging over het initiëren van geheugengebeurtenissen, " zei hij over de studie van calmodulin van zijn collega's. "Ons priondocument ging over het behoud van het geheugen, aan het einde van het leerproces. En actine zit in het midden. Er kunnen veel andere dingen in het midden zijn, te.
"Deze grote vragen zijn voor veel mensen interessant, "zei hij. "Dit is een belangrijk element van het probleem, maar het is duidelijk niet het einde van het verhaal."
 Chemici verbeteren de methode om natuurlijke antioxidanten uit laurierblaadjes te extraheren
Chemici verbeteren de methode om natuurlijke antioxidanten uit laurierblaadjes te extraheren Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing
Door zelfassemblage geïnduceerde luminescentie van Eu3+-complexen voor bioimaging-toepassing Kunnen we plastic tassen recyclen tot stoffen van de toekomst?
Kunnen we plastic tassen recyclen tot stoffen van de toekomst? Een gemakkelijkere manier om vegetarisch te worden:vitamine B12 kan worden geproduceerd tijdens deegfermentatie
Een gemakkelijkere manier om vegetarisch te worden:vitamine B12 kan worden geproduceerd tijdens deegfermentatie Metaalionkatalysatoren en waterstofperoxide kunnen de plasticproductie groener maken
Metaalionkatalysatoren en waterstofperoxide kunnen de plasticproductie groener maken
Hoofdlijnen
- Dammen en andere barrières voor paaigebieden voor zalm zorgen voor uitdagingen voor visserijbeheerders
- Onderzoeksartikelen werpen licht op een decennium lang stamcelmysterie
- Diepe wortels in planten aangedreven door bodemhydrologie
- Wat is er met androgyn gebeurd?
- Verkoudheidsvirussen onthullen een van hun sterke punten
- Langstlevende dolfijn in gevangenschap sterft in aquarium Japan
- Onderzoekers genereren tomaten met verbeterde antioxiderende eigenschappen door genetische manipulatie
- Geschiedenis van de aarde: tijdlijn, proces en feiten
- Voedselgeur verbetert de aantrekkelijkheid van mannelijke vliegen
- Het op maat maken van het oppervlak van koolstof kan de sleutel zijn tot het in realtime monitoren van het bloed van de patiënt

- Wetenschappers lossen ruwe olie op in water om de samenstelling ervan te bestuderen

- Onderzoekers ontwikkelen techniek om koolstofdioxide en methaan te hergebruiken

- Geleidbaarheid Vs. concentratie

- Kristaloorlogen:onderzoek kan leiden tot efficiëntere methoden voor kristaltechnologie

 Hoe SLPM naar SCFM te converteren
Hoe SLPM naar SCFM te converteren  Academische prestaties worden beïnvloed door hoe leerlingen gender op school doen
Academische prestaties worden beïnvloed door hoe leerlingen gender op school doen Klopt het dat het grillen van vlees kanker kan veroorzaken?
Klopt het dat het grillen van vlees kanker kan veroorzaken?  Welke seizoenen hebben overstromingen?
Welke seizoenen hebben overstromingen?  Onderzoek:productiviteit van onderlinge fondsen neemt toe wanneer seksuele intimidatie op de werkplek wordt geëlimineerd
Onderzoek:productiviteit van onderlinge fondsen neemt toe wanneer seksuele intimidatie op de werkplek wordt geëlimineerd De vechtende vrouwen van Afrika verzamelen plastic om scholen te bouwen
De vechtende vrouwen van Afrika verzamelen plastic om scholen te bouwen  Nieuw onderzoek wijst op waarschijnlijke hydrologische implicaties van snelle opwarming van de aarde
Nieuw onderzoek wijst op waarschijnlijke hydrologische implicaties van snelle opwarming van de aarde Nieuwe lithiumbatterijen van gebruikte mobiele telefoons
Nieuwe lithiumbatterijen van gebruikte mobiele telefoons
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

