
Wetenschap
Banden die binden, en kan worden losgemaakt
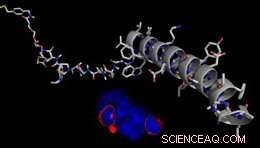
Model van een REductief Splitsbare AgONist (RECON) voor de omkeerbare controle van GPCR-afhankelijke celsignaleringsroutes. Credit:J. Broichhagen, D. Hodson
LMU-onderzoekers hebben een methode ontwikkeld waarmee celoppervlakreceptoren naar believen kunnen worden in- en uitgeschakeld. De techniek belooft nieuwe inzichten te verschaffen in receptorfuncties en hun effecten op intracellulaire signaalroutes.
G-eiwit-gekoppelde transmembraanreceptoren (GPCR's) zijn nauw betrokken bij de regulering van een breed scala aan biologische processen. Ze werken door extracellulaire boodschappermoleculen - zoals hormonen - te binden en intracellulaire signaalrelais te activeren die celfuncties op specifieke manieren veranderen. Niet verrassend, functionele defecten in deze membraangebonden receptoren leiden vaak tot chronische fysiologische aandoeningen. Dit verklaart waarom een groot deel van het huidige farmacologische onderzoek zich richt op het vinden van medicijnen die gericht zijn op specifieke GPCR's. Een onderzoekssamenwerking met groepen onder leiding van professoren Anja Hoffmann-Röder (hoogleraar organische chemie) aan de LMU, Dirk Trauner (voorheen LMU, nu aan de New York University) en David Hodson (University of Birmingham) heeft nu een reeks moleculen ontworpen waarmee GPCR's (en mogelijk andere receptortypes) farmacologisch naar believen kunnen worden geactiveerd en gedeactiveerd. Deze middelen beloven nieuwe aspecten te ontdekken van de moleculaire mechanismen die ten grondslag liggen aan de werking van receptoren, en zou daarbij de ontwikkeling van nieuwe therapeutische strategieën moeten vergemakkelijken. De nieuwe bevindingen verschijnen in het online tijdschrift ACS Centrale Wetenschap .
De nieuwe studie is gebaseerd op eerder werk waarin het team met behulp van 'SNAP-tags' een lichtafhankelijk farmacologisch systeem had ontwikkeld. Een SNAP-tag is een bindend eiwit dat op genetische wijze in een doelreceptoreiwit kan worden geïntroduceerd. Het doel is om te fungeren als een bindingsplaats voor de aanhechting van een synthetisch ligand, die dan receptorsignalering kan moduleren, d.w.z. activering activeren of blokkeren. Het nieuwe artikel beschrijft de toepassing van deze techniek op een receptor genaamd GLP-1R, die de secretie van insuline regelt. Het vormt daarom een aantrekkelijk doelwit voor de ontwikkeling van geneesmiddelen om diabetes te behandelen. "We gebruikten als ligand een natuurlijk hormoon dat was uitgerust met een synthetische extensie die fungeert als een adapter die covalent wordt gebonden door de SNAP-tag. Binding van het hormoon activeert de receptor, terwijl de directe bevestiging van de adapter aan de SNAP-tag ervoor zorgt dat de receptor in de AAN-status wordt gehouden, " legt Tom Podewin (Max Planck Instituut voor Medisch Onderzoek) uit, gezamenlijke eerste auteur van de nieuwe studie en tot 2017 een doctoraatsstudent in de groep van Hoffmann-Röder. Bevestiging van het adapteruiteinde aan de SNAP-tag bindt de ligand effectief aan de receptor. Echter, de adapter is flexibel verbonden met de hormoonbindende plaats van de receptor via een disulfidebinding, die gemakkelijk kan worden gebroken door toevoeging van een reductiemiddel. Deze truc zorgt ervoor dat het hormoon vrijkomt van zijn bindingsplaats, waardoor de interactie wordt omgekeerd en de receptor weer wordt uitgeschakeld.
Om de veelzijdigheid van deze 'tethered farmacologie'-benadering aan te tonen, het team gebruikte een ander synthetisch ligand om een receptor te activeren die de afscheiding van groeihormoon regelt. "Onze liganden zijn eigenlijk de grootste bekende gebonden moleculen waarvan is aangetoond dat ze werken als activatoren of agonisten voor membraangebonden receptoren. Dit bewijst dat gebonden farmacologie niet beperkt is tot het gebruik van kleine moleculen, maar kan worden uitgebreid tot peptiden en misschien zelfs tot eiwitten, " merkt Hoffmann-Röder op.
Omdat binding aan de SNAP-tag covalent is, het activerende ligand kan niet gemakkelijk van de receptor worden vrijgemaakt in afwezigheid van een reductiemiddel. Normaal gesproken, geactiveerde GPCR's worden onmiddellijk uit het celmembraan verwijderd en naar intracellulaire blaasjes getransporteerd. Eenmaal daar, hun liganden dissociëren en ze worden vervolgens gerecycled naar het celoppervlak. Echter, vonden de onderzoekers – tot hun verbazing – dat binding van het synthetische ligand dit recyclageproces remt, het vangen van de receptor in het blaasje. "Het vermogen om een ligand - of het nu een farmacologisch middel of een tag voor gebruik bij bio-imaging is - duurzaam te hechten aan een geschikt gemodificeerde receptor, biedt nieuwe mogelijkheden voor de manipulatie en karakterisering van complexe signaalroutes in cellen, " voegt gezamenlijke eerste auteur Johannes Broichhagen toe. Hij en zijn collega's zijn van mening dat de nieuwe methode een beter begrip van receptoren en hun functies zal opleveren, wat ongetwijfeld gevolgen zal hebben voor de ontwikkeling van geneesmiddelen in de toekomst.
 Poreuze kristallen gebruiken om licht te oogsten
Poreuze kristallen gebruiken om licht te oogsten Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen
Nieuwe grens voor 3D-printen ontwikkelt ultramoderne zachte materialen die zichzelf kunnen herstellen Onderzoek levert potentiële bioblendstock op voor dieselbrandstof
Onderzoek levert potentiële bioblendstock op voor dieselbrandstof Nieuw record voor lengte koolstof-koolstof enkelvoudige binding
Nieuw record voor lengte koolstof-koolstof enkelvoudige binding Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
Kunstmatige antimicrobiële peptiden kunnen helpen om resistente bacteriën te overwinnen
 Nieuw inzicht in hoe magma vulkaanuitbarstingen voedt
Nieuw inzicht in hoe magma vulkaanuitbarstingen voedt Bescherming nodig voor opkomende mijnbouwhotspots
Bescherming nodig voor opkomende mijnbouwhotspots Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten
Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten Wetenschappers reconstrueren het lente-hydroklimaat met behulp van levende en dode alpenjeneverbesstruiken
Wetenschappers reconstrueren het lente-hydroklimaat met behulp van levende en dode alpenjeneverbesstruiken Wildvuur in Nieuw-Zeeland zal naar verwachting wekenlang branden
Wildvuur in Nieuw-Zeeland zal naar verwachting wekenlang branden
Hoofdlijnen
- Zeegras is wereldwijd een belangrijk visgebied
- Wat doet zich voor als de Zygote één minder chromosoom heeft dan het gebruikelijke?
- Ideeën voor celademhaling
- De verschillen tussen mitochondriën en chloroplasten in structuur
- Amazoneboeren ontdekten het geheim van het domesticeren van wilde rijst 4, 000 jaar geleden
- DNA-modellen van paperclips maken
- Hoe kan een babyrobotzeehond een medisch hulpmiddel zijn?
- Hoe Dopamine sommige voedingsmiddelen verslavend maakt
- Vetmolecuul in menselijk bloed controleert malariaparasieten beslissing om op muggen te springen
 Grafeen maakt rubber rubberachtiger
Grafeen maakt rubber rubberachtiger Nieuwe elektronenmicroscopie biedt nanoschaal, schadevrije isotopentracking in aminozuren
Nieuwe elektronenmicroscopie biedt nanoschaal, schadevrije isotopentracking in aminozuren Coronavirus:een architect over hoe de pandemie onze huizen voor altijd kan veranderen
Coronavirus:een architect over hoe de pandemie onze huizen voor altijd kan veranderen Waarom mensen software-updates uitstellen, ondanks de risico's
Waarom mensen software-updates uitstellen, ondanks de risico's NASA ziet tyfoon Phanfone aan land komen op de Filippijnen
NASA ziet tyfoon Phanfone aan land komen op de Filippijnen Lichaamsdelen van een bidsprinkhaan
Lichaamsdelen van een bidsprinkhaan  De mythe van de eeuwigdurende beweging ontkrachten:wat is nulpuntsenergie?
De mythe van de eeuwigdurende beweging ontkrachten:wat is nulpuntsenergie?  Op maat gemaakte verharding van bulkmetaalglas veroorzaakt door 2-D gradiëntverjonging
Op maat gemaakte verharding van bulkmetaalglas veroorzaakt door 2-D gradiëntverjonging
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Swedish | Dutch | Danish | Norway | Portuguese | German |

-
Wetenschap © https://nl.scienceaq.com






