
Wetenschap
Onderzoekers ontdekken structuur van anti-verouderingshormoon
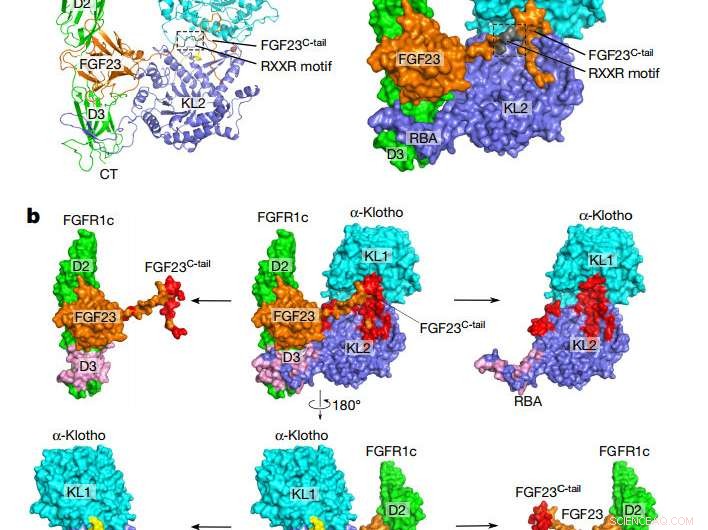
Algemene topologie van het FGF23-FGFR1cecto-α-klothoecto-complex. een, Cartoon (links) en oppervlakterepresentatie (rechts) van de ternaire complexe structuur. De α-klotho KL1 (cyaan) en KL2 (blauw) domeinen zijn verbonden door een korte proline-rijke linker (geel; niet zichtbaar in de oppervlaktepresentatie). FGF23 is oranje met het proteolytische splitsingsmotief in grijs. FGFR1c is in het groen. CT, C-terminus; NT, N-eindpunt. B, Bindende interfaces tussen α-klothoecto en het FGF23-FGFR1cecto-complex. Het ternaire complex (midden) wordt weergegeven in twee verschillende oriëntaties die verband houden met een rotatie van 180° langs de verticale as. FGF23-α-klothoecto (rood) en FGFR1cecto-α-klothoecto (roze) interfaces worden gevisualiseerd door α-klothoecto en het FGF23-FGFR1cecto-complex van elkaar weg te trekken. De gescheiden componenten worden links en rechts van het ternaire complex getoond. Credit: Natuur (2018). DOI:10.1038/natuur25010
Een nieuwe studie onthult de moleculaire structuur van een eiwit genaamd alfa(α)Klotho, en hoe het helpt om een hormonaal signaal door te geven dat veroudering vertraagt.
Geleid door onderzoekers van de NYU School of Medicine en online gepubliceerd op 17 januari in Natuur , de studie weerlegt 20 jaar vermoeden dat αKlotho - genoemd naar de Griekse godin die de levensdraad spint - een belangrijk anti-verouderingshormoon is. In plaats daarvan schrijven de resultaten deze functie toe aan fibroblastgroeifactor 23 (FGF23), en leg uit hoe αKlotho FGF23 eenvoudig helpt om zijn anti-verouderingswerking te bemiddelen.
Studies al in 1997 hadden aangetoond dat muizen die genetisch werden gemanipuleerd om ofwel αKlotho ofwel FGF23 te missen, last hadden van vroegtijdige veroudering, waaronder vroeg optredende hart- en vaatziekten, kanker, en cognitieve achteruitgang. Door een eerste blik te werpen op de structuur van de geassocieerde groep eiwitten die FGF23 omvat, zijn receptoreiwit (FGFR), en αKlotho, de huidige studie heft het dogma op dat αKlotho op zichzelf werkt als een levensduurfactor.
"Door te laten zien dat alle manieren waarop αKlotho organen moest beschermen, in plaats daarvan voortkomen uit zijn vermogen om het FGF23-signaal te helpen, we hebben nieuw licht geworpen op de onderliggende oorzaak van veroudering, " zegt hoofdonderzoeksauteur Moosa Mohammadi, doctoraat, professor in de afdeling Biochemie en Moleculaire Farmacologie aan de NYU Langone Health. "Onze nieuwe structurele gegevens maken ook de weg vrij voor het ontwerp van nieuwe middelen die FGF23-αKlotho-signalering naar behoefte kunnen stimuleren of blokkeren."
Structuur lost mysterie op
Om de atomaire structuur van de FGF23-signaleringsgroep van eiwitten te bepalen, Mohammadi en collega's gebruikten röntgenkristallografie. Het team lokte eerst het FGF23-hormoon uit, samen met zijn receptoreiwit (FGFR) en αKlotho, om uit een oplossing te komen en stapels herhalingen te vormen, ordelijke kristallen. Vervolgens stelden ze de kristallen bloot aan röntgenstralen, en gebruikte de gereflecteerde patronen om de atomaire structuur van de eiwitten te berekenen.
De nieuwe studie levert het eerste bewijs van hoe FGF23 alleen signalen naar cellen kan sturen door een complex te vormen met αKlotho, zijn receptor, en een andere partner in heparansulfaat. Gemaakt door botcellen, het is bekend dat het FGF23-hormoon via de bloedbaan naar cellen in andere organen reist, waar het zijn bericht aflevert door zijn receptor aan te meren en aan te zetten. De nieuw opgeloste complexe structuur onthult hoe αKlotho FGF23 aan zijn receptor bindt met voldoende vasthoudendheid om het te activeren.
De studie werpt ook nieuw licht op hoe nierziekte leidt tot een abnormale verdikking van hartspierweefsel, hypertrofie genaamd. Harthypertrofie is een belangrijke doodsoorzaak bij mensen met beschadigde niertubuli, veroorzaakt door (bijvoorbeeld) hoge bloeddruk en diabetes. Wanneer beschadigde niertubuli niet langer voldoende fosfaat in de urine kunnen verwijderen, FGF23 stijgt in een poging om bloedfosfaat onder controle te houden, gedeeltelijk door het beheersen van vitamine D. Een heersende hypothese is dat zeer hoge niveaus van FGF23 hypertrofie in het hart veroorzaken, maar de theorie bleef controversieel omdat hartweefsel geen αKlotho heeft, die aanwezig moet zijn als FGF23 moet signaleren.
Eerdere studies hadden aangetoond dat de bekendste vorm van αKlotho immobiel is, gebonden zijn aan de oppervlaktemembranen van cellen in niertubuli, de bijschildklier, en bepaalde delen van de hersenen. Toen ontdekten onderzoekers dat een deel van het αKlotho-eiwit dat uit de celoppervlakken steekt, het ecto-domein, kan worden afgesneden en in circulerende lichaamsvloeistoffen terechtkomen, en daardoor het hart zou kunnen bereiken. vroeg bewijs, echter, suggereerde dat afgeworpen αKlotho niet in staat was om als een FGF23-co-receptor te werken. De nieuwe studie integreert deze waarnemingen door aan te tonen dat circulerende αKlotho inderdaad kan functioneren net als zijn membraangebonden vorm om FGF23-signalering mogelijk te maken.
De onderzoekers zeggen dat hun bevindingen een nieuwe race voor de ontwikkeling van geneesmiddelen in nierziekte zullen lanceren. Mohammadi had al aangetoond dat een belangrijk onderdeel van het FGF23-hormoon (zijn C-terminale staartpeptide), wanneer geïnjecteerd in muizen, concurreert met intact FGF23 om zijn signaal te verminderen en hypertrofie van het hart te voorkomen. In aanvulling, het team ontwerpt al nieuwe moleculen die het FGF23/shed αKlotho-signaal veranderen op basis van de nieuw ontdekte eiwitstructuren.
De studie suggereert ook dat een verwant eiwit, beta-Klotho, dient als dezelfde soort co-receptor om FGF21 te helpen, een hormoon gerelateerd aan FGF23. FGF21 functioneert door signalen te sturen die de bloedsuikerspiegel en vetzuren in balans houden, met gevolgen voor diabetes en obesitas.
 Moleculaire basis van effecten van medicijnen op de ontwikkeling van ledematen en oren onthuld
Moleculaire basis van effecten van medicijnen op de ontwikkeling van ledematen en oren onthuld Nieuwe trucjes leren van zeesponzen, naturen meest onwaarschijnlijke civiel ingenieurs
Nieuwe trucjes leren van zeesponzen, naturen meest onwaarschijnlijke civiel ingenieurs Chemici testen het vermogen van Chemica om synthetische routes te genereren
Chemici testen het vermogen van Chemica om synthetische routes te genereren Eiwitten die tegen de hitte kunnen
Eiwitten die tegen de hitte kunnen Nieuw instrument om terrorisme te bestrijden
Nieuw instrument om terrorisme te bestrijden
Hoofdlijnen
- Hoe duplicaten in twee rijen in OpenOffice te verwijderen
- Is maretak meer dan alleen een excuus voor een kus?
- Wat is de belangrijkste primaire producent in het mariene ecosysteem?
- Een DNA-model maken met behulp van pijpreinigers
- Wat doet zich voor als de Zygote één minder chromosoom heeft dan het gebruikelijke?
- Salamander-genoom geeft aanwijzingen over uniek regeneratief vermogen
- Zeven nieuwe spinnensoorten uit Brazilië vernoemd naar zeven beroemde fictieve spinnenpersonages
- Vergelijking van het menselijk oog met een camera
- Onderzoek werpt nieuw licht op hoe organismen energie gebruiken in een menigte
- Complexe moleculen samenstellen

- Onderzoekers ontdekken dat 2-D overgangsmetaalcarbiden reageren met water, een deur openen naar hun onbekende chemie

- Katalysator voor de koolstofvrije productie van waterstofgas uit ammoniak
- Geavanceerde polymeren helpen de waterzuivering te stroomlijnen, milieusanering

- Gecombineerde röntgen- en fluorescentiemicroscoop onthult onzichtbare moleculaire details
 Programmeren met de lichtschakelaar
Programmeren met de lichtschakelaar Kleine supermagneten kunnen de toekomst zijn van medicijnafgifte
Kleine supermagneten kunnen de toekomst zijn van medicijnafgifte Honger achtervolgt zuidelijk Afrika naarmate de klimaatcrisis dieper wordt
Honger achtervolgt zuidelijk Afrika naarmate de klimaatcrisis dieper wordt Landing van de Mars 2020-rover:automatische piloot vermijdt autonoom terreingevaren
Landing van de Mars 2020-rover:automatische piloot vermijdt autonoom terreingevaren Nieuw inzicht in hoe hond en mens zij aan zij jaagden, meer dan 8000 jaar geleden
Nieuw inzicht in hoe hond en mens zij aan zij jaagden, meer dan 8000 jaar geleden Boeing-astronautencapsule maandenlang aan de grond door klepprobleem
Boeing-astronautencapsule maandenlang aan de grond door klepprobleem Mensen migreerden veel eerder naar Mongolië dan eerder werd aangenomen
Mensen migreerden veel eerder naar Mongolië dan eerder werd aangenomen Venezolaanse communicatiesatelliet buiten dienst
Venezolaanse communicatiesatelliet buiten dienst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

