
Wetenschap
Ontdekkingslichtpad voor onderzoek naar Alzheimer
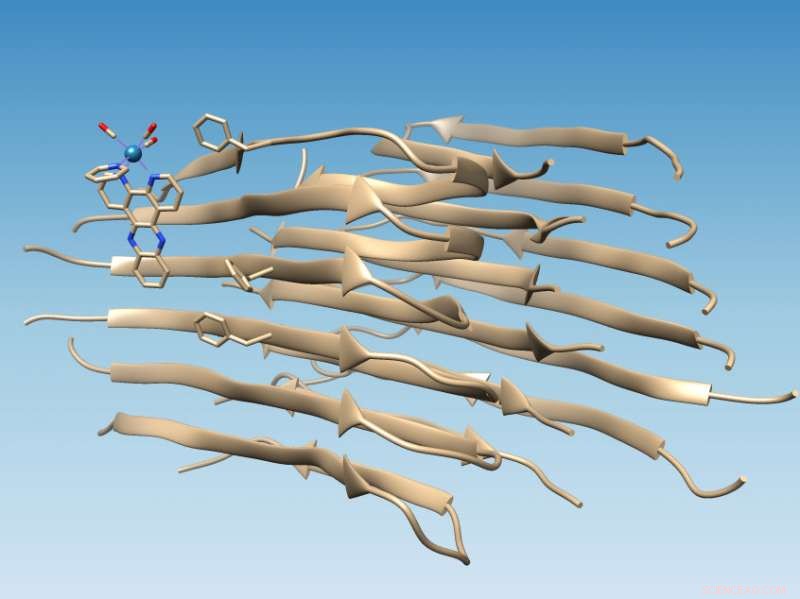
Een op renium gebaseerd complex, ontwikkeld aan de Rice University, bindt aan fibrillen van verkeerd gevouwen amyloïde beta-peptide, die de locatie markeert van een hydrofobe spleet die zou kunnen dienen als doelwit voor medicijnen, en oxideert de fibril, die de chemie verandert op een manier die verdere aggregatie zou kunnen voorkomen. Krediet:Martí Group/Rice University
Een sonde die is uitgevonden aan de Rice University en die oplicht wanneer deze zich bindt aan een verkeerd gevouwen amyloïde bèta-peptide - het soort waarvan wordt vermoed dat het de ziekte van Alzheimer veroorzaakt - heeft een specifieke bindingsplaats op het eiwit geïdentificeerd die betere medicijnen zou kunnen bieden om de ziekte te behandelen.
Nog beter, het lab heeft ontdekt dat wanneer de metalen sonde wordt verlicht, het katalyseert de oxidatie van het eiwit op een manier waarvan zij denken dat het kan voorkomen dat het aggregeert in de hersenen van patiënten.
De studie op lange amyloïde fibrillen ondersteunt computersimulaties door collega's van de Universiteit van Miami die voorspelden dat het fotoluminescente metaalcomplex zich zou hechten aan het amyloïde peptide in de buurt van een hydrofobe (watervermijdende) spleet die op het oppervlak van het fibrilaggregaat verschijnt. Die kloof vormt een nieuw doelwit voor drugs.
Het vinden van de site was relatief eenvoudig toen het laboratorium van Rice-chemicus Angel Martí zijn op rhenium gebaseerde complexen gebruikte om fibrillen aan te pakken. Het lichtschakelcomplex gloeit wanneer het wordt geraakt met ultraviolet licht, maar wanneer het zich aan de fibril bindt, wordt het meer dan 100 keer helderder en veroorzaakt het oxidatie van het amyloïde peptide.
"Het is alsof je op het strand loopt, ' zei Marti. 'Je kunt zien dat er iemand voor je was door naar de voetstappen in het zand te kijken. Hoewel we het reniumcomplex niet kunnen zien, we kunnen de oxidatie (voetafdruk) die het produceert op het amyloïde peptide vinden.
"Die oxidatie gebeurt alleen vlak naast de plek waar het bindt, " zei hij. "Het echte belang van dit onderzoek is dat we met een hoge mate van zekerheid kunnen zien waar moleculen kunnen interageren met amyloïde bètafibrillen."
De studie verschijnt in het tijdschrift Chemo .
"We geloven dat deze hydrofobe spleet een algemene bindingsplaats is (op amyloïde bèta) voor moleculen, " zei Martí. "Dit is belangrijk omdat amyloïde beta-aggregatie is geassocieerd met het begin van de ziekte van Alzheimer. We weten dat fibrillair onoplosbaar amyloïde bèta giftig is voor celculturen. Oplosbare amyloïde oligomeren die zijn gemaakt van verschillende verkeerd gevouwen eenheden van amyloïde beta zijn ook giftig voor cellen, waarschijnlijk zelfs meer dan fibrillair.
"Er is interesse in het vinden van medicijnen die de schadelijke effecten van amyloïde bèta-aggregaten zullen doven, " zei hij. "Maar om medicijnen voor deze te maken, we moeten eerst weten hoe medicijnen of moleculen in het algemeen kunnen binden en interageren met deze fibrillen, en dat was niet zo bekend. Nu hebben we een beter idee van wat het molecuul nodig heeft om te interageren met deze fibrillen."

Een metalen sonde licht op wanneer deze zich bindt aan een verkeerd gevouwen amyloïde beta-peptide in een experiment aan de Rice University. De sonde identificeerde een bindingsplaats die betere medicijnen zou kunnen vergemakkelijken om de ziekte van Alzheimer te behandelen. Krediet:Brandon Martin/Rice University
Wanneer amyloïde peptiden goed vouwen, ze verbergen hun hydrofobe resten terwijl ze hun hydrofiele (wateraantrekkende) resten blootstellen aan water. Dat maakt de eiwitten oplosbaar, zei Mart. Maar wanneer amyloïde bèta zich verkeerd vouwt, het laat twee hydrofobe resten achter, bekend als Valine 18 en Fenylalanine 20, blootgesteld om de hydrofobe kloof te creëren.
"Het is perfect, omdat dan moleculen met hydrofobe domeinen worden aangestuurd om daar te binden, " zei Martí. "Ze zijn compatibel met deze hydrofobe spleet en associëren met de fibril, een sterke interactie vormen."
Als de resulterende oxidatie ervoor zorgt dat de fibrillen niet verder aggregeren in de kleverige substantie die in de hersenen van Alzheimerpatiënten wordt gevonden, het kan het begin zijn van een nuttige strategie om de aggregatie te stoppen voordat de symptomen van de ziekte verschijnen.
"Het is een heel aantrekkelijk systeem omdat het gebruik maakt van licht, wat een goedkope hulpbron is, "Zei Martí. "Als we complexen kunnen aanpassen zodat ze rood licht absorberen, die transparant is voor weefsel, kunnen we deze fotochemische modificaties misschien uitvoeren in levende dieren, en misschien ooit bij mensen."

Van links, Rice University-onderzoeker Christopher Pennington, afgestudeerde student Bo Jiang en Angel Martí, een universitair hoofddocent chemie en bio-engineering, voer een amyloïde bèta-experiment uit in het Martí-lab. Krediet:Brandon Martin/Rice University
Hij zei dat lichtactivering de onderzoekers in staat stelt om "uitstekende controle" over oxidatie te hebben.
"We stellen ons voor dat het op een dag mogelijk zou kunnen zijn om de symptomen van de ziekte van Alzheimer te voorkomen door amyloïde bèta te richten op dezelfde manier waarop we cholesterol bij mensen nu behandelen om hart- en vaatziekten te voorkomen, ' zei Martí. 'Dat zou geweldig zijn.'
Hoofdlijnen
- Wilgenroosje:de roze pionier
- Mendelian Vs. Moderne genetica
- Appelbomen dragen meer fruit als ze omringd zijn door goede buren
- Science Fair-projecten met nagellak
- Welke soorten moleculen kunnen door het plasmamembraan worden gevoerd door eenvoudige diffusie?
- Bijenschadelijke pesticiden in 75 procent van de honing wereldwijd:studie
- Saguaro en andere torenhoge cactussen hebben een roerige geschiedenis
- Wat is de Western Blot-test?
- Welke Organelle vormt de basis voor Cilia en Flagella?
- Kunstmatig longkankerweefsel kan helpen bij het vinden van nieuwe medicamenteuze behandelingen

- Onderzoekers stellen kristalstructuur van maagprotonpomp vast
- Elektrolytboost verbetert de prestaties van waterige dual-ion-batterijen

- Nieuwe antimicrobiële coating kan de sleutel zijn in de strijd tegen ziekenhuisinfecties

- Cyborg-bacteriën presteren beter dan planten wanneer ze zonlicht omzetten in nuttige verbindingen
 Hoe congestieprijzen het probleem van de vervuiling van New York kunnen afremmen
Hoe congestieprijzen het probleem van de vervuiling van New York kunnen afremmen  Kunstmatige intelligentie trainen met kunstmatige röntgenstralen
Kunstmatige intelligentie trainen met kunstmatige röntgenstralen Soorten planten in de Indische Oceaan
Soorten planten in de Indische Oceaan De helling van een lijn vinden op basis van 2 punten
De helling van een lijn vinden op basis van 2 punten Verontrustende omvang van plasticvervuiling onthuld
Verontrustende omvang van plasticvervuiling onthuld Zwaartekrachtonderzoeken met behulp van een mobiele atoominterferometer
Zwaartekrachtonderzoeken met behulp van een mobiele atoominterferometer Perfect bewaard gebleven dinosaurushuid gevonden in Korea
Perfect bewaard gebleven dinosaurushuid gevonden in Korea K-Athena:een draagbare magnetohydrodynamica-code voor prestaties
K-Athena:een draagbare magnetohydrodynamica-code voor prestaties
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


