
Wetenschap
Pinda-familiegeheim voor het maken van chemische bouwstenen onthuld
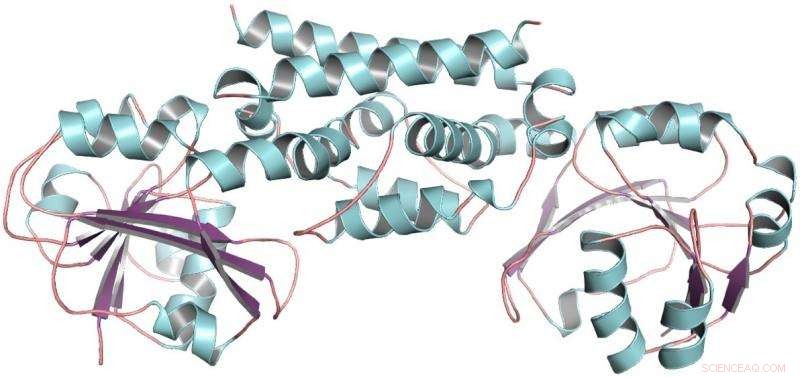
De driedimensionale structuur van het PDH-enzym uit soja, een peulvrucht. Deze structuur hielp aantonen dat slechts één mutatie peulvruchten in staat stelde een nieuwe manier te ontwikkelen om het aminozuur tyrosine te maken. Krediet:Craig Schenck
Terwijl je in je volgende boterham met pindakaas en jam bijt, kauw hierop:de pinda die je eet heeft een geheim.
Het is een subtiele. De pinda en zijn verwanten - peulvruchten - hebben er geen, maar twee manieren om het aminozuur tyrosine te maken, een van de 20 die nodig zijn om al zijn eiwitten te maken, en een essentiële menselijke voedingsstof. Dat lijkt misschien klein, maar waarom deze plantenfamilie een unieke manier heeft om zo'n belangrijke chemische bouwsteen te maken, is een mysterie dat teruggaat tot de jaren zestig en er een is die de aandacht heeft getrokken van Hiroshi Maeda, een professor in de botanie aan de Universiteit van Wisconsin-Madison.
"We zijn geïnteresseerd in plantenchemie, proberen te begrijpen hoe planten zoveel verschillende chemische verbindingen maken, waarvan vele belangrijk zijn voor onze menselijke samenleving als voedsel, vezel, voeden, brandstof, geneeskunde - zoveel dingen, ' zegt Maeda.
Die belangrijke moleculen gaan uit van eenvoudiger verbindingen, zoals tyrosine, dat is de voorloper van morfine en talloze andere interessante en nuttige chemicaliën.
In nieuw onderzoek gepubliceerd in het nummer van 26 juni van Natuur Chemische Biologie , Maeda en zijn afgestudeerde student Craig Schenck, samen met medewerkers aan de Washington University in St. Louis, rapporteren hoe de peulvruchtenfamilie haar tweede tyrosine-route heeft ontwikkeld. Ze ontdekten de structuur van een nieuw plantenenzym, een die een nuttig hulpmiddel zou kunnen zijn voor biotechnologen die de productie van tyrosine en zijn derivaten proberen te beheersen. En ze koppelden een grote evolutionaire verandering in het plantenmetabolisme aan een enkele mutatie in het nieuwe enzym.
In de jaren ’60 en ’70, wetenschappers onderzochten de plantenwereld om te ontdekken hoe ze belangrijke metabolische verbindingen maakten, zoals aminozuren. Terwijl alle planten één pad gebruikten, bekend als ADH, om tyrosine te maken, de peulvruchtenfamilie - erwten, bonen, pinda's - op unieke wijze een tweede toegevoegd, genaamd PDH, die anders alleen in microben werd gevonden. Niemand wist waarom, en het probleem werd opzij gezet.
Maar twee jaar geleden Maeda en Schenck stoften het oude mysterie van zich af. ingraven, ze ontdekten de genen die verantwoordelijk zijn voor het maken van tyrosine. Ze ontdekten dat de peulvruchten hun PDH-enzymen hadden ontwikkeld uit bestaande ADH-enzymen, net voordat pinda's en erwten evolueerden naar afzonderlijke geslachten. De zusterenzymen leken erg op elkaar, wat betekende dat slechts een klein aantal veranderingen kon verklaren hoe de ADH-enzymen zich ontwikkelden tot de PDH-enzymen. Maar er waren nog te veel veranderingen om één voor één te testen om te zien welke effect hadden.
Toen kreeg Maeda een telefoontje van Joe Jez, een biochemicus aan de Washington University. Met Jez' leerling Cynthia Holland, de twee teams werkten samen om het PDH-enzym van soja te zuiveren, een peulvrucht, en bepalen de driedimensionale structuur. Met de structuur van PDH in de hand, Schenck kon zien dat in de loop van de evolutionaire tijd, er waren slechts een paar mutaties opgetreden op de plaats waar de chemische reacties plaatsvinden. In plaats van tientallen mutaties om te proberen, hij had er maar twee.
Schenck ontdekte dat door een enkel aminozuur in het centrum van het enzym te veranderen, hij was in staat om het soja-PDH-enzym grotendeels terug om te zetten in zijn voorouder ADH-enzym. De schakelaar werkte voor enzymen van meerdere soorten, en werkte omgekeerd:Schenck kon ADH-enzymen van niet-peulvruchten PDH-achtige eigenschappen geven.
Maeda en Schenck hadden ontdekt dat peulvruchten een nieuwe manier ontwikkelden om een belangrijke chemische stof te maken, meestal door te struikelen over een enkele, cruciale schakelaar.
"Het meest verrassende resultaat is dat een enkel residu echt een grote rol speelde bij het overschakelen naar het maken van dit peulvrucht-specifieke enzym, ", zegt Maeda. "En dat roept een interessante vraag op waarom andere groepen planten dit unieke enzym nooit hebben ontwikkeld. Omdat gewoon met een willekeurige kans, misschien is deze mutatie opgetreden, maar nooit gehandhaafd."
Waarom peulvruchten vasthielden aan hun nieuwe tyrosineroute, en welk voordeel het zou kunnen opleveren, zal meer werk vergen.
Nog een afhaalmaaltijd, zegt Maeda, is dat dezelfde schakelaar die ADH-enzymen in PDH-enzymen verandert, het vermogen van tyrosine om de functie van het enzym te remmen, uitschakelt. Hoewel dit soort zelfregulering normaal gesproken nuttig is voor cellen, Maeda denkt dat de PDH-ongevoeligheid voor tyrosine een zegen zou kunnen zijn om te helpen meer tyrosine te produceren, en zijn bruikbare derivaten, in systemen zoals gist of gemanipuleerde planten.
"De gedachte is dat papaver, bijvoorbeeld, tyrosine maakt via een standaard ADH-route die waarschijnlijk wordt geremd door tyrosine, " legt Schenck uit, die onlangs zijn doctoraat behaalde in het lab van Maeda, mogelijke toepassingen voor het nieuwe onderzoek bespreken. "Als we een enzym kunnen introduceren dat niet wordt geremd door tyrosine, misschien kunnen we de totale voorraad van de voorloper tyrosine vergroten voor het verhogen van de morfineproductie. Het kan in de toekomst een nuttig hulpmiddel zijn in andere plantensoorten of zelfs in microben."
 Apparaat verfijnt analyse van materialen voor brandstofcellen en batterijen
Apparaat verfijnt analyse van materialen voor brandstofcellen en batterijen Chemici komen een stap dichter bij het nabootsen van de natuur met assemblage van nieuwe 3D-structuren
Chemici komen een stap dichter bij het nabootsen van de natuur met assemblage van nieuwe 3D-structuren Ontwikkeling van cellulaire membraan-FET (lipid-FET) voor gevoeligheid van biosensor
Ontwikkeling van cellulaire membraan-FET (lipid-FET) voor gevoeligheid van biosensor Damp drijft een vloeistof-vaste overgang in een moleculair systeem aan
Damp drijft een vloeistof-vaste overgang in een moleculair systeem aan Het terugwinnen van fosfor uit de productie van maïs-ethanol kan de grondwatervervuiling helpen verminderen
Het terugwinnen van fosfor uit de productie van maïs-ethanol kan de grondwatervervuiling helpen verminderen
Hoofdlijnen
- Geowetenschappers vergelijken micro-organismen in de poolgebieden
- Hoe kan licht virussen doden?
- Bio-ethicus bespreekt vier sleutels om te weten over mogelijkheden, valkuilen van genbewerking
- Feiten over lipiden
- Moeten we de genen van buitengewone mensen sparen voor klonen?
- Wetenschappers vinden antarctische microben die alleen van lucht leven
- Colombia - een megadivers paradijs dat nog ontdekt moet worden
- Maak een lijst van de soorten informatie die gevonden kan worden door de sequentie van een DNA-molecuul te kennen Molecule
- Hoe je geur te verbergen voor honden
- Diagnostisch hulpmiddel voor coronavirus maakt belangrijke stap voorwaarts

- Wetenschappers pionieren met nieuw chemisch conversieproces bij lage temperatuur
- zachter, veiligere haarverf op basis van synthetische melanine

- Regenen, regenen, ga weg:nieuwe waterdichtingsoplossing ontdekt

- Chemici brachten gevouwen eiwitten tot leven

 Bio-geïnspireerd enzymmodel met een redox-schakelaar
Bio-geïnspireerd enzymmodel met een redox-schakelaar Hoe de diameter van ronde objecten te meten
Hoe de diameter van ronde objecten te meten  Wat onderscheidt mensen van chimpansees en andere apen?
Wat onderscheidt mensen van chimpansees en andere apen?  Hoe Nostradamus werkt
Hoe Nostradamus werkt  Ontmoet je innerlijke hagedis
Ontmoet je innerlijke hagedis Vaarwel Cassini:ruimtevaartuig Saturnus krijgt grappige opera-uitzending
Vaarwel Cassini:ruimtevaartuig Saturnus krijgt grappige opera-uitzending Hoe lang duren papieren platen om te ontleden?
Hoe lang duren papieren platen om te ontleden?  Biosynthese van wijdverspreide pigmenten van bacteriën onthuld
Biosynthese van wijdverspreide pigmenten van bacteriën onthuld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

