Wetenschap
Een kus des doods om het onbedwingbare te verdoven
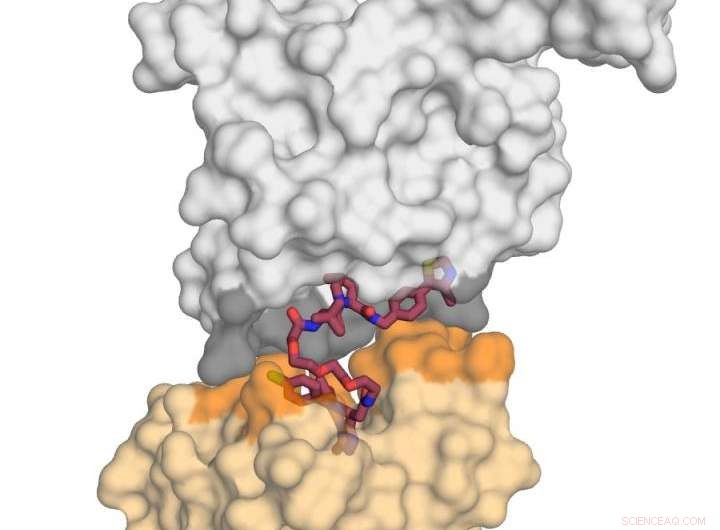
Afbeelding toont het E3-ligase-eiwit VHL (in grijs) in complex met het kleine molecuul MZ1 (in framboos) en 'kissing' het eiwit BRD4 (in geel). Bij het ontvangen van deze dodelijke 'kus', BRD4 is gericht op degradatie. Krediet:Xavier Lucas, Alessio Ciulli, Universiteit van Dundee
Wetenschappers van de Universiteit van Dundee hebben een grote doorbraak gemeld in het aanpakken van de oorzaken van vele ziekten, het gebruik van een 'kus des doods' om eiwitten te vernietigen die voorheen als 'niet-geneesbaar' werden beschouwd.
Er is veel bekend over eiwitten zoals Ras en Myc waarvan bekend is dat ze verantwoordelijk zijn voor kanker bij de mens, en Huntingtine, die de ziekte van Huntingdon veroorzaakt, maar tot nu toe zijn ze hardnekkig resistent gebleken tegen pogingen om manieren te vinden om ze met medicijnen aan te pakken.
Nu hebben onderzoekers onder leiding van professor Alessio Ciulli van de School of Life Sciences in Dundee een manier gevonden om vergelijkbare eiwitten aan te pakken, op een onconventionele manier een benadering met kleine moleculen gebruiken om 'slechte' eiwitten aan te pakken door ze te binden aan neutraliserende middelen om een afbraakproces te starten, en daardoor volledig te verwijderen.
"We kennen veel eiwitten die actief zijn bij het veroorzaken van ziekten, maar die we niet hebben kunnen verhinderen om 'schurk' te worden of om ze te stoppen wanneer ze dat wel doen, zei professor Ciulli.
"Het grootste probleem is dat we er niet in zijn geslaagd de kleine moleculen te vinden die met succes aan deze eiwitten kunnen binden en tegelijkertijd hun functie kunnen belemmeren. Het is een zeer complex gebied - deze eiwitten kunnen regelgevers in de cel vaak voor de gek houden en extreem zijn. moeilijk vast te stellen met remmers.
“Onderzoek in ons lab heeft de afgelopen jaren bijgedragen aan een andere aanpak, een theorie waarover al vele jaren wordt getheoretiseerd, maar die nu pas volledig wordt gerealiseerd door dit nieuwste werk. In plaats van het kleine molecuul te gebruiken om te proberen het slechte eiwit uit te schakelen, we hebben een manier ontwikkeld om het te modificeren zodat het kan worden gebruikt om de neutraliserende eiwitten aan te trekken, die zich vervolgens binden aan hun slechte buur en ertegen optreden, het starten van een cascadeproces van degradatie.
"Cruciaal, we hebben ook ontdekt dat het niet genoeg is dat dit neutraliserende eiwit dicht bij het slechte eiwit zit, het moet er direct contact mee maken, om het te 'kussen'. En niet zomaar een piemeltje, maar een echte `Gone With The Wind' omhelzing. We noemen dit een 'kus des doods', omdat het de sleutel is om de afbraak van het slechte eiwit te verzekeren."
Professor Ciulli en collega's richtten hun aandacht op een bivalent chemisch afbrekend molecuul genaamd 'PROTAC' (Proteolyse-gerichte chimere moleculen). Ze hebben de eerste röntgenkristalstructuur kunnen creëren van een PROTAC gebonden aan zowel het 'slechte' eiwit als het 'neutraliserende' middel (een E3-ubiquitine-ligase), en ontdekte dat het met succes kan worden ingezet als een 'magneet' om de twee doeleiwitten samen te trekken.
"Deze ontdekking biedt de allereerste inzichten in hoe PROTAC's werken en hoe we eiwitten op een zeer selectieve manier kunnen richten op afbraak, zei professor Ciulli.
"Dit presenteert een paradigmaverschuiving in hoe we selectieve chemische interventie kunnen garanderen tegen eiwitten waarvan we weten dat ze factoren zijn bij het veroorzaken van ziekten, maar die tot nu toe onmogelijk waren om met succes aan te pakken. Het wijst in de richting van de mogelijkheid om het 'niet-geneesbare' te drogeren."
De resultaten van het onderzoek worden gepubliceerd in het tijdschrift Natuur Chemische Biologie .
Het werk van het Dundee-team was gericht op het koppelen van een van de BET-bromdomeineiwitten, BRD4, dat een aantrekkelijk doelwit is voor kanker, met een selectieve BRD4 `degrader' genaamd MZ1. Ze ontdekten dat MZ1 de twee eiwitten samen kon trekken door in zichzelf te vouwen. Als de twee eiwitten eenmaal zijn samengevoegd in hun 'kus', leiden de interacties tussen hen tot degradatie van het doelwit. Ze lieten zien hoe vergelijkbare eiwitten BRD2 en BRD3 het neutraliserende eiwit niet zo goed kussen, en op basis van deze informatie waren ze in staat om nieuwe afbraakproducten te ontwerpen die die eiwitten volledig van het afbraakproces vrijwaren. Dit is belangrijk omdat het verduidelijkt hoe afbrekende moleculen in de toekomst kunnen worden ontworpen om off-target effecten te minimaliseren op manieren die misschien niet mogelijk zijn met conventionele remmers.
Het Dundee-team dat aan het project werkte, omvatte postdoctorale onderzoekers in het laboratorium van professor Ciulli, Morgan Gadd, Andrea Testa, Xavier Lucas en Kwok-Ho Chan, en Wengzhan Chan en Dougie Lamont van de Dundee Fingerprints Proteomics Facility.
Professor Ciulli zei dat er al veelbelovende tekenen waren van de farmaceutische industrie van aanzienlijke investeringen in dit onderzoeksgebied.
"We begrijpen nu beter hoe we remmers in afbrekers kunnen veranderen. De weg om afbrekers in medicijnen te veranderen zal lang en bochtig zijn en we kunnen er niet alleen komen. Het is opwindend om tekenen van serieuze betrokkenheid van de farmaceutische industrie te zien, wat bijdraagt aan het optimisme dat we in staat zullen zijn om het punt te bereiken waarop we het 'niet-geneesbare' kunnen verdoven."
 Anti-aromatisch molecuul vertoont record elektrische geleiding
Anti-aromatisch molecuul vertoont record elektrische geleiding Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt
Hoe bacteriën een enzym bouwen dat klimaatveranderend lachgas vernietigt Maakt het mogelijk om grotere 3D-geprinte objecten te maken met keramiek
Maakt het mogelijk om grotere 3D-geprinte objecten te maken met keramiek Katalytische hydrogenering van kooldioxide tot methanol
Katalytische hydrogenering van kooldioxide tot methanol Waarom veranderen Pennies van kleur?
Waarom veranderen Pennies van kleur?
Hoofdlijnen
- Synthetische seks in gist belooft veiligere medicijnen voor mensen
- Hoe maak je een 3D-model van het spierstelsel voor een wetenschapsklasse
- Afbraak in het Noordpoolgebied
- Wat zijn de functies van Triglyceride Phospholipid & Sterol?
- Snellere Salmonella-test verhoogt voedselveiligheid voor mens en dier
- Voorbeelden van genetische kenmerken
- Hoe kan iemand 11 dagen wakker blijven?
- Wetenschappers brengen nieuwe inzichten in de erfelijkheid van de ernst van de hiv-infectie
- Wilde dieren vormen grote bedreiging voor Outback, klimaatverandering studie vindt
 Grafeenlaag zou de snelheid van condensatie-warmteoverdracht in productie-installaties kunnen verviervoudigen
Grafeenlaag zou de snelheid van condensatie-warmteoverdracht in productie-installaties kunnen verviervoudigen Facebook luisterde naar gebruikersgesprekken:rapport
Facebook luisterde naar gebruikersgesprekken:rapport Nieuwe synaptische architectuur voor op de hersenen geïnspireerd computergebruik
Nieuwe synaptische architectuur voor op de hersenen geïnspireerd computergebruik Waarom werken magneten beter als ze koud zijn?
Waarom werken magneten beter als ze koud zijn?  Wat zijn energiegerelateerde organellen?
Wat zijn energiegerelateerde organellen?  Wetenschappers vragen om meer ogen in de lucht te midden van alarmerende klimaatverandering
Wetenschappers vragen om meer ogen in de lucht te midden van alarmerende klimaatverandering Het potentieel van kwantumtunneling benutten:transistors zonder halfgeleiders
Het potentieel van kwantumtunneling benutten:transistors zonder halfgeleiders Hoe maak je een citroenzuurbufferoplossing
Hoe maak je een citroenzuurbufferoplossing
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com