
Wetenschap
Welke soorten bindingen komen vaker voor in het niet-waterige binnenmilieu van een eiwit dan in een waterig oppervlakte-eiwit?
1. Hydrofobe interacties :Dit zijn niet-covalente interacties die voortkomen uit de neiging van niet-polaire (hydrofobe) moleculen of gebieden van moleculen om te aggregeren in waterige oplossingen om contact met water te minimaliseren. In het niet-waterige binnenste van het eiwit clusteren hydrofobe zijketens van aminozuren samen om een stabiele kern te vormen, met uitzondering van watermoleculen.
2. Van der Waals-strijdkrachten :Dit zijn zwakke, niet-covalente interacties, waaronder dipool-dipoolinteracties, geïnduceerde dipool-dipoolinteracties en Londense dispersiekrachten. Van der Waals-krachten dragen bij aan de algehele stabiliteit en compactheid van het interieur van het eiwit door extra stabilisatie van de hydrofobe kern te bieden.
3. Waterstofbruggen :Hoewel waterstofbruggen ook veel voorkomen op het waterige oppervlak van eiwitten, kunnen ze zich ook vormen in het niet-waterige interieur. Deze waterstofbruggen komen voor tussen polaire of geladen zijketens van aminozuren die niet direct worden blootgesteld aan watermoleculen.
4. Disulfidebindingen :Disulfidebindingen zijn covalente bindingen gevormd tussen de zwavelatomen van cysteïneresiduen. Deze bindingen komen vaker voor in het binnenste van eiwitten, waar de reducerende omgeving van het cytosol wordt afgeschermd van de oxiderende extracellulaire omgeving. Disulfidebindingen dragen bij aan de structurele stabiliteit en stijfheid van eiwitten.
Aan de andere kant wordt het waterige oppervlak van een eiwit gekenmerkt door verschillende soorten bindingen:
1. Waterstof verbindt zich met water :De polaire en geladen zijketens van aminozuren op het oppervlak van het eiwit vormen waterstofbruggen met watermoleculen, wat bijdraagt aan de hydratatie en oplosbaarheid van het eiwit in het waterige milieu.
2. Ionische bindingen :Dit zijn elektrostatische interacties tussen positief en negatief geladen groepen op het eiwitoppervlak en tegengesteld geladen ionen in de omringende waterige oplossing. Ionische bindingen spelen een cruciale rol bij het behouden van de algehele lading van het eiwit en de interacties met andere moleculen.
3. Polaire interacties :Polaire interacties zoals dipool-dipoolinteracties en dipool-geïnduceerde dipoolinteracties vinden plaats tussen polaire zijketens van aminozuren en watermoleculen of andere polaire moleculen in het waterige milieu.
 Organische eutectica met kleine moleculen tonen potentieel voor het vervangen van kunststoffen
Organische eutectica met kleine moleculen tonen potentieel voor het vervangen van kunststoffen  Suikers synthetiseren:scheikundigen ontwikkelen methode om de opbouw van koolhydraten te vereenvoudigen
Suikers synthetiseren:scheikundigen ontwikkelen methode om de opbouw van koolhydraten te vereenvoudigen structurele kleuren, zonder de glans
structurele kleuren, zonder de glans Video:Is het echt alleen chemisch reinigen?
Video:Is het echt alleen chemisch reinigen? Hoe wordt papier in het kort gemaakt?
Hoe wordt papier in het kort gemaakt?
 Omgevallen trein geeft inzicht in grondbeweging, oorsprong van de aardbeving van 1906
Omgevallen trein geeft inzicht in grondbeweging, oorsprong van de aardbeving van 1906 Vervuiling richt grote schade aan op het immuunsysteem van koralen
Vervuiling richt grote schade aan op het immuunsysteem van koralen Landbouw vervangt fossiele brandstoffen als grootste menselijke bron van zwavel voor het milieu
Landbouw vervangt fossiele brandstoffen als grootste menselijke bron van zwavel voor het milieu Studie bevestigt meer media-aandacht voor klimaatverandering gewenst
Studie bevestigt meer media-aandacht voor klimaatverandering gewenst Hoe duurzame zalm te kopen:een deskundige gids die de nuance van milieukeurmerken navigeert
Hoe duurzame zalm te kopen:een deskundige gids die de nuance van milieukeurmerken navigeert
Hoofdlijnen
- Hoe wetenschappers het Cheerios-effect omkeerden
- Hoe extrusie van epitheelcellen wordt gereguleerd door dichtheid
- Vogelambassadeurs en tribale perspectieven:een vogelperspectief van voorgeschreven vuur
- Ontdekking van virus bij varroamijten geeft hoop op verbetering van overleving van honingbij
- Wat zijn de algemene kenmerken van Monerans?
- Waarom verliezen sommige vogels sneller hun vlucht dan andere?
- Hoe biologische antropologie werkt
- Wat is de betekenis van staafvormige bacteriën?
- Wat hebben alle levende organismen gemeen?
- Tsjaad breidt belangrijk natuurgebied in nationaal park uit

- Nieuwe vlindersoort ontdekt in Rusland met een ongewone set van 46 chromosomen

- Zijn eicellen van ouder wordende primaten beschermd tegen mutaties?
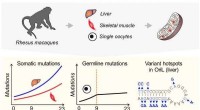
- Gezondheidsonderzoekers visualiseren een leven in silico

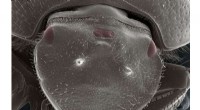
- Biologen maken kever met functioneel extra oog
 Onderzoek laat zien hoe consumenten afhankelijk zijn van de prijs om de kwaliteit van producten te bepalen
Onderzoek laat zien hoe consumenten afhankelijk zijn van de prijs om de kwaliteit van producten te bepalen  Onderzoekers lieten bijna de oplossing van een wiskundig raadsel wegglippen
Onderzoekers lieten bijna de oplossing van een wiskundig raadsel wegglippen Studie:Uitbreiding van telewerken zou vervuiling tot 10% verminderen
Studie:Uitbreiding van telewerken zou vervuiling tot 10% verminderen Kīlauea lavabrandstoffen fytoplankton bloeien voor het eiland Hawaï
Kīlauea lavabrandstoffen fytoplankton bloeien voor het eiland Hawaï Zijn millennials genderrebellen of keren ze terug naar traditie?
Zijn millennials genderrebellen of keren ze terug naar traditie? Factoren die de schaalbaarheid van turbulentie beïnvloeden
Factoren die de schaalbaarheid van turbulentie beïnvloeden Afvalwater gereinigd dankzij een nieuw adsorberend materiaal gemaakt van fruitschillen
Afvalwater gereinigd dankzij een nieuw adsorberend materiaal gemaakt van fruitschillen De transpolaire drift hapert - zee-ijs smelt nu voordat het de kinderkamer kan verlaten
De transpolaire drift hapert - zee-ijs smelt nu voordat het de kinderkamer kan verlaten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

