
Wetenschap
Mobiele genetische elementen kunnen onbedoeld bacteriële immuunsystemen onderdrukken, zo blijkt uit onderzoek
Bacteriële restrictiemodificatiesystemen zijn verantwoordelijk voor het beschermen van cellen tegen vreemd genetisch materiaal, bijvoorbeeld bacteriofagen en plasmiden. Immuunsystemen vereisen strikte regulering, omdat bacteriën, net als mensen, auto-immuunreacties kunnen hebben:een aanval op hun eigen DNA.
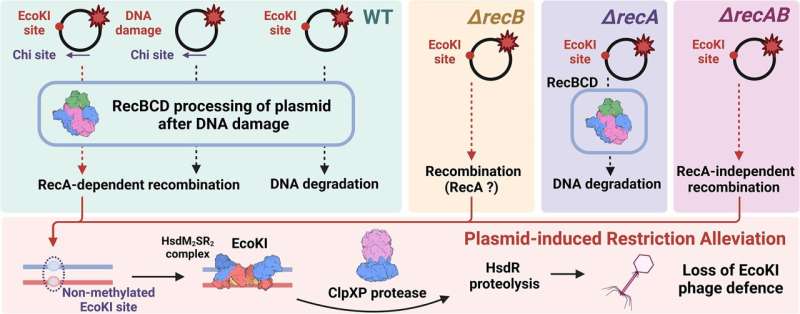
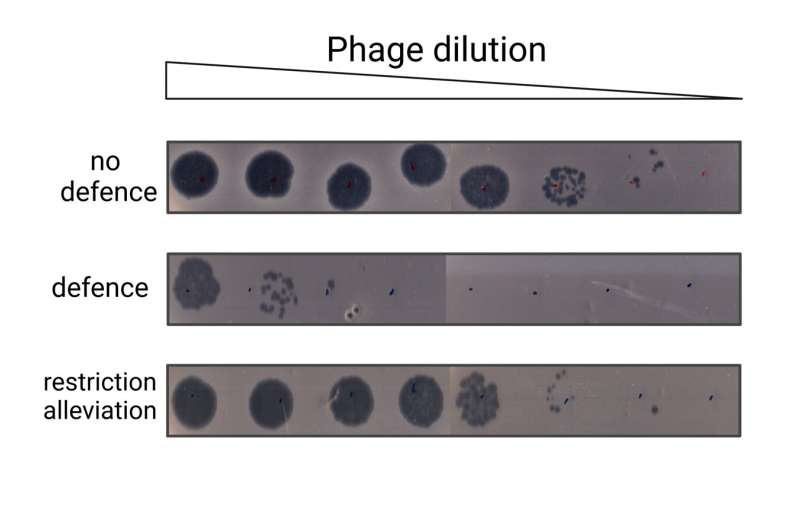
Een onderzoeksgroep onder leiding van Artem Isaev, het hoofd van het Metagenome Analysis Laboratory bij Skoltech, bestudeerde een van de eerste ontdekte bacteriële immuunsystemen, EcoKI, en ontdekte dat de aanwezigheid van plasmide-DNA in een cel leidt tot de activering van restrictieverlichting, een ingebouwd immuunonderdrukkingsprogramma. Dit effect wordt plasmide-geïnduceerde restrictieverlichting genoemd. Het treedt op wanneer plasmiden met speciale eigenschappen de cel binnenkomen, waardoor een conflict met de intracellulaire immuniteit ontstaat. De resultaten worden gepresenteerd in het Nucleic Acids Research dagboek.
Plasmiden zijn een vorm van mobiele genetische elementen, circulaire DNA-moleculen die bacteriën actief met elkaar uitwisselen, wat leidt tot hun snelle verspreiding onder de bevolking.
“De ontdekking bleek voor ons volkomen onverwacht. We bestudeerden een eiwit dat het EcoKI-systeem zou remmen, maar konden de gegevens niet verklaren. Toen dachten we:zou het plasmide-DNA zelf verantwoordelijk kunnen zijn voor het onderdrukken van de bacteriële immuniteit? bleek dat de aanwezigheid van een plasmide, dat speciale elementen heeft (EcoKI-herkenningsplaatsen), EcoKI-nuclease naar plasmide-DNA trok, wat afbraak van dit eiwit mogelijk maakte.
“Dit programma is nodig om de cel te beschermen tegen een onbedoelde nuclease-aanval op het bacteriële chromosoom, maar het bleek dat plasmide-DNA ook kan dienen als een ‘spons’ die EcoKI-nuclease aantrekt en naar proteolyse kanaliseert, waardoor de bacteriële immuniteit volledig wordt uitgeschakeld. Dit is ook schadelijk voor het plasmide zelf, omdat de cel gevoelig wordt voor faaginfectie. We veronderstellen dus dat dit conflict onbedoeld plaatsvindt en eenvoudigweg een weerspiegeling is van de complexiteit van verschillende biologische mechanismen die elkaar soms kunnen verstoren", aldus Artem. Isaev, de leider van het project.
De bevindingen hebben bijgedragen aan een beter begrip van bacteriële recombinatieprocessen, waardoor een enkel DNA-molecuul fragmenten kan uitwisselen met zijn kopie binnen een cel. De cel repareert DNA-breuken in het bacteriële genoom door middel van een proces van homologe recombinatie. Dit proces vereist ook een speciale reeks, een zogenaamde Chi-site. Als deze plaats wordt verwijderd, kan een dubbelstrengige breuk leiden tot volledige afbraak van het beschadigde DNA-plasmide.
"We hebben vastgesteld dat om restrictieverlichting te veroorzaken, het plasmide een Chi-site nodig heeft, dat wil zeggen het vermogen om actief te recombineren. Als we echter onder speciale omstandigheden de celcomponenten verwijderen die verantwoordelijk zijn voor de belangrijkste recombinatieroute (RecBCD en RecA eiwitten), kunnen we nog steeds verlichting van de restricties waarnemen.
"Dit suggereert dat er verborgen of alternatieve recombinatieroutes in de bacteriële cel zijn die zich niet manifesteren in de aanwezigheid van RecBCD en RecA. Ons nieuwe modelsysteem zal helpen deze mechanismen te onderzoeken", aldus Mikhail Skutel en Daria Yanovskaya, de leidende auteurs. van de studie, afgestudeerde studenten van het Life Sciences-programma van Skoltech.