
Wetenschap
Onderzoekers bestuderen de complexiteit van homologe recombinatie en abnormale chromosoombruggen
Het intact houden van de genetische informatie die is opgeslagen in genomisch DNA tijdens de celdelingscyclus is van cruciaal belang voor bijna alle levensvormen. Uitgebreide DNA-schade veroorzaakt steevast verschillende ongunstige genomische herschikkingen, die in de beste gevallen tot celdood kunnen leiden en in het ergste geval tot het optreden van ziekten zoals kanker.
Gelukkig delen cellen in alle drie de domeinen van het leven een eigenaardig, foutloos mechanisme voor het behouden van genetische informatie, bekend als homologe recombinatie (HR).
Het proces van HR begint wanneer een cel DNA-schade tegenkomt tijdens de DNA-synthese of daarna, waardoor een cascade van gebeurtenissen op gang komt. Het beschadigde DNA wordt eerst weggesneden of geknipt om enkelstrengige uiteinden nabij de beschadigde plaats te creëren. Deze uiteinden worden vervolgens gekoppeld aan het overeenkomstige gebied in een beschikbaar gerepliceerd chromosoom, ook bekend als 'zusterchromatide', dat in wezen wordt gebruikt als sjabloon om het beschadigde DNA te repareren.
Zoals je zou verwachten omvat de HR-route een groot aantal eiwitten en cellulaire machines. Hoewel de meeste van deze eiwitten en cellulaire machines goed bestudeerd zijn, blijven sommige ervan enigszins raadselachtig. Dat is het geval met de regulatoren van RAD51, een eiwit dat verantwoordelijk is voor het repareren van dubbelstrengige DNA-breuken.
Normaal gesproken vormt RAD51 filamenten die helpen bij het behouden van DNA-replicatievorken - voorbijgaande arrangementen van DNA die vaak voorkomen tijdens DNA-replicatie, zoals bij het instorten van de replicatievork. Een goede regulatie van RAD51, evenals de afbraak van deze filamenten nadat hun doel is bereikt, is essentieel voor HR.
De precieze mechanismen waardoor abnormale RAD51-accumulatie tot genetische instabiliteit leidt, worden echter nog niet volledig begrepen, en veel positieve en negatieve RAD51-regulatoren blijven onduidelijk.
Nu echter in een recent artikel gepubliceerd in Nucleic Acid Research op 10 april 2024 onderzocht een onderzoeksteam onder leiding van professor Miki Shinoara van de afdeling Advanced Bioscience, Kindai University, Japan, de nauwe relatie tussen RAD51 en FIGNL1, een van de belangrijkste toezichthouders. De studie is mede-auteur van Kenichiro Matsuzaki, eveneens van het Department of Advanced Bioscience, Kindai University, en werpt het broodnodige licht op de complexiteit van het HR-proces.
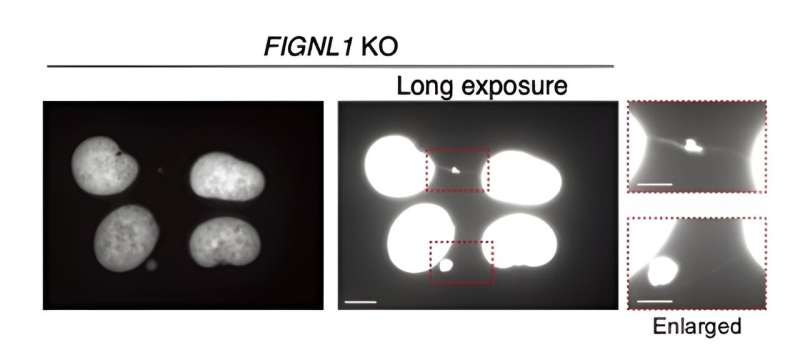
Ten eerste hebben de onderzoekers menselijke cellen genetisch gemanipuleerd die FIGNL1 niet tot expressie brachten (dat wil zeggen FIGNL1 KO-cellen), met behulp van de beproefde CRISPR/Cas9-methode. Vervolgens brachten ze met behulp van geavanceerde immunokleuringstechnieken met zorgvuldig geselecteerde antilichamen en fluorescentiemicroscopie het HR-proces in detail in beeld, op zoek naar indicatoren van afwijkingen.
Door deze aanpak te combineren met een overvloed aan andere experimentele procedures, zoals Western blotting, celcyclusanalyse, eiwittesten en genomische en transcriptomische analyses, zijn ze erin geslaagd een uitgebreid beeld te krijgen van wat er in een cel gebeurt als FIGNL1 ontbreekt.
P>Uit de resultaten blijkt dat FIGNL1 een zeer gespecialiseerd RAD51-ontmantelingsenzym is dat nodig is voor een goede chromosoomscheiding nadat de replicatievorken zijn "gedemonteerd".
Meer specifiek, wanneer RAD51-filamenten niet volledig worden ontmanteld, vinden er tijdens de mitose abnormale gebeurtenissen plaats die onopgeloste tussenproducten produceren. Dit leidt uiteindelijk tot de vorming van zogenaamde ‘chromosoombruggen’ tussen de zusterchromatiden. Deze ultrafijne structuren zijn zeer schadelijk voor de normale werking van de cel en veroorzaken de verspreiding van catastrofale genetische informatie.
Het begrijpen van de fijnere details van het HR-traject, de belangrijkste spelers en de vele subprocessen ervan is uiterst belangrijk, niet alleen vanuit biologisch perspectief, maar ook vanuit medisch oogpunt.
"Celdood als gevolg van ontregeling van HR is een belangrijk mechanisme waardoor geneesmiddelen tegen kanker kankercelspecifieke cytotoxiciteit vertonen", legt prof. Shinohara uit. "Tot nu toe was het belangrijkste doelwit een tekort aan HR-activatie, maar de resultaten van dit onderzoek laten zien dat aanhoudende activering van RAD51 ook cytotoxiciteit vertoont en een moleculair doelwit kan zijn voor geneesmiddelen tegen kanker."
Bovendien kan de cellulaire machinerie die betrokken is bij het HR-traject worden ingezet als een krachtig bio-engineering-instrument.
“HR is een goed bewaard gebleven systeem onder de meeste soorten en is ook nauw verbonden met technologieën voor genmodificatie, zoals genome editing en gentargetingtechnologieën”, zegt prof. Shinohara, “waardoor de mechanismen worden opgehelderd die de recombinase-activiteit controleren, zoals dat van RAD51, kan bijdragen aan het verhogen van de efficiëntie van genmodificatietechnieken."
Vermeldenswaard is dat genetische manipulatie een zeer effectieve manier is om de gewasopbrengst te verhogen en om microbiële organismen aan te passen voor taken zoals bioremediatie, waarmee verschillende moderne wereldproblemen worden aangepakt.
Over het geheel genomen werpen de bevindingen van deze studie niet alleen licht op een universeel biologisch proces, maar maken ze ook de weg vrij voor een beter begrip van cellulaire mechanismen voor belangrijke medicijnontdekkingen en vooruitgang op het gebied van genetische manipulatie.