
Wetenschap
Mysterie CRISPR ontgrendeld:een nieuwe bondgenoot tegen antibioticaresistentie?
CRISPR-Cas-systemen zijn bacteriële adaptieve immuunsystemen die zich richten op de nucleïnezuren (DNA/RNA) van binnendringende genetische parasieten zoals bacteriofagen (fagen) en deze snijden; virussen die bacteriële cellen infecteren en uiteindelijk doden. Ze bestaan uit twee hoofdcomponenten; de CRISPR-array, die het immuungeheugen van eerdere virale infecties opslaat, en de cas-genen (die coderen voor Cas-eiwitten), die verantwoordelijk zijn voor het coördineren van de verschillende stadia van de immuunrespons.
Er zijn momenteel zes typen CRISPR-Cas-systemen bekend, ingedeeld op basis van hun eiwitsamenstelling. Alle typen, behalve type IV, omvatten nucleasen voor DNA/RNA-splitsing.
CRISPR-Cas-systemen zijn populair geworden als hulpmiddelen voor het bewerken van genen, waardoor nauwkeurige programmeerbare sneden op specifieke genomische locaties mogelijk zijn, wat uiteindelijk heeft geleid tot de toekenning van de Nobelprijs voor de Scheikunde 2020 voor de ontwikkeling van deze technologie.
Het mysterie van de ontbrekende componenten oplossen
"Type IV-systemen zijn de vreemde neven onder de CRISPR-Cas-systemen, omdat ze de immuungeheugenacquisitiemodule en de DNA-knipcomponent missen die CRISPR-Cas-systemen zo beroemd hebben gemaakt. Deze kenmerken, en hun strikte associatie met mobiele circulaire DNA-moleculen, plasmiden genoemd, motiveerde ons om de taak op zich te nemen om hun intrigerende rol en onderliggende moleculaire functies op te lossen", legt Fabienne Benz uit, postdoc aan de Universiteit van Kopenhagen en co-eerste auteur van een onderzoek over dit onderwerp gepubliceerd in Cell Host &Microbe .
Omdat het kenmerk van CRISPR-Cas het vermogen is om DNA op specifieke locaties te knippen, werken de Type IV-systemen op een totaal andere manier. Ze missen de typische nuclease-schaar, maar herbergen in plaats daarvan een DinG-helicase:een mysterieus eiwit dat DNA afwikkelt.
"Het keerpunt in dit onderzoek kwam toen we ons realiseerden dat type IV-systemen het DNA niet knippen. In plaats daarvan ontdekten we dat ze genexpressie op hun doellocaties tot zwijgen brengen. Dit is een unieke functionaliteit die belangrijke biotechnologische toepassingen zou kunnen hebben", zegt Rafael Pinilla. -Redondo, assistent-professor bij de afdeling Biologie en hoofdonderzoekscoördinator van het onderzoek.
De onderzoekers bereikten een nieuwe doorbraak toen ze ontdekten hoe deze systemen kunnen functioneren zonder de noodzakelijke componenten om immuungeheugen te creëren.
"Type IV-systemen kunnen het ontbreken van een geheugenacquisitiemodule omzeilen door compatibele modules te kapen van andere CRISPR-Cas-systemen die aanwezig zijn in de gastheerbacterie. Dit is fascinerend omdat deze andere systemen slechts in de verte verwant zijn", legt Sarah Camara-Wilpert uit, co- eerste auteur van deze studie.
Veelbelovende CRISPR-tool om superbugs te bestrijden
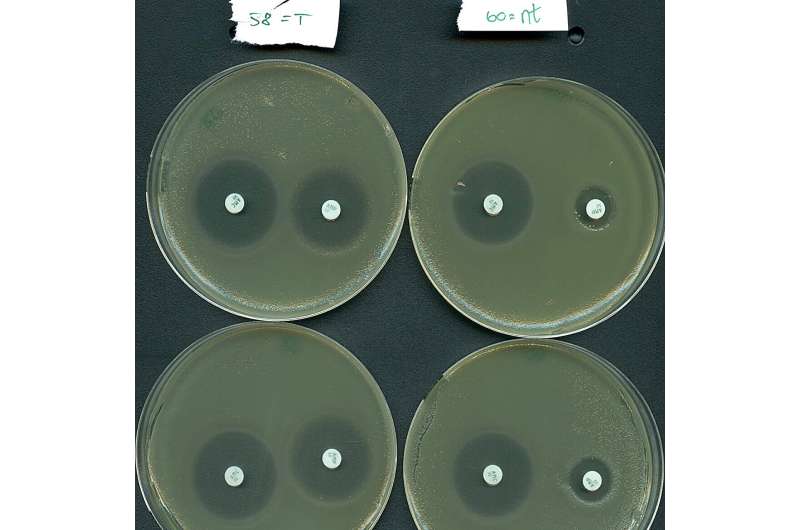
Maar waar gaat al die hype over? Welnu, het blijkt dat Type IV-systemen een duidelijke neiging hebben om zich op natuurlijke wijze op plasmiden te richten, in plaats van op bacteriële virussen. Belangrijk is dat de beoogde plasmiden vaak meerdere antibioticaresistentiegenen herbergen, zoals die gevonden worden in superbacteriën in ziekenhuizen. Er wordt geschat dat antimicrobiële resistentie jaarlijks rechtstreeks verantwoordelijk is voor meer dan 1 miljoen sterfgevallen als gevolg van falende behandelingen.
Geïnspireerd door hun natuurlijke plasmide-targeting-functie, hebben de onderzoeksteams effectief een type IV-systeem geherprogrammeerd om selectief resistentiegenen uit te schakelen die worden gedragen door een risicovolle bacterie van ziekenhuispatiënten.
"Onze resultaten geven aan dat de Type IV-systemen potentieel hebben als een nieuw middel om antibioticaresistentie te bestrijden, omdat we erin geslaagd zijn een belangrijke ziekteverwekker opnieuw gevoelig te maken voor behandeling met antibiotica", zegt professor Søren Sørensen, mede-laatste auteur van het onderzoek. /P>
Deze studie was een grote interdisciplinaire inspanning waarbij zeven internationale onderzoeksgroepen uit verschillende landen betrokken waren. Hoewel het project begon als een samenwerking tussen slechts twee groepen, kreeg het geleidelijk aan momentum en trok het partners met uiteenlopende expertise aan.
“We ervaarden een prachtig sneeuwbaleffect, waarbij elke nieuwe partner de impact van het werk versterkte door hun unieke vaardigheden te delen en cruciale inzichten te verschaffen om de mysteries rond type IV-systemen op te lossen. Het was een collaboratief hoogstandje, precies hoe de wetenschap zou moeten zijn", merkt Pinilla-Redondo op.