
Wetenschap
Wetenschappers verhelderen substraatherkenning en protonkoppelingsmechanisme van transporteiwit VMAT2
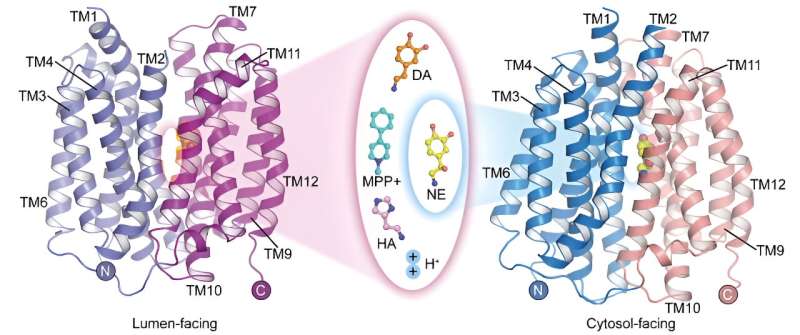
Vesiculaire monoaminetransporter 2 (VMAT2) is het enige transporteiwit in het centrale zenuwstelsel dat de opslag van monoamine-neurotransmitters bemiddelt. Het speelt een cruciale rol bij het mediëren van de overdracht van zenuwimpulsen en neuroprotectie.
Momenteel zijn de mechanismen waarmee VMAT2 verschillende structureel verschillende monoamine-neurotransmitters en de ziekte-inductor MPP van Parkinson herkent en transporteert + zijn niet duidelijk, en het moleculaire mechanisme van proton-gekoppeld substraattransport moet ook verder worden onderzocht.
In een onderzoek gepubliceerd in Cell Research op 22 mei heeft een onderzoeksteam onder leiding van prof. Zhao Yan van het Instituut voor Biofysica van de Chinese Academie van Wetenschappen (CAS), in samenwerking met prof. Jiang Daohua van het Instituut voor Natuurkunde van CAS, de apo-structuur van menselijke vesiculaire monoamine transporter 2 (hVMAT2) bij lage pH, de complexe structuren van blaasjes tegenover dopamine, noradrenaline, histamine en het neurotoxine MPP + binding, en de complexe structuur van noradrenalinebinding in de naar het cytosol gerichte toestand.
Deze structuren onthullen de structurele basis van VMAT2-substraatherkenning en verfijnen het moleculaire mechanisme van proton-gekoppeld substraattransport verder.
Hoewel noradrenaline, dopamine, serotonine en MPP + Omdat ze verschillende moleculaire structuren hebben, tonen de complexe structuren van VMAT2-binding aan deze substraten aan dat ze allemaal binden aan vergelijkbare posities op het transportereiwit. Subtiele verschillen in bepaalde functionele groepen van deze substraten leiden echter tot significante en kritische verschillen in hun interacties en bindingswijzen met het transporteiwit. Deze verschillen illustreren hoe VMAT2 verschillende substraatmoleculen efficiënt herkent.
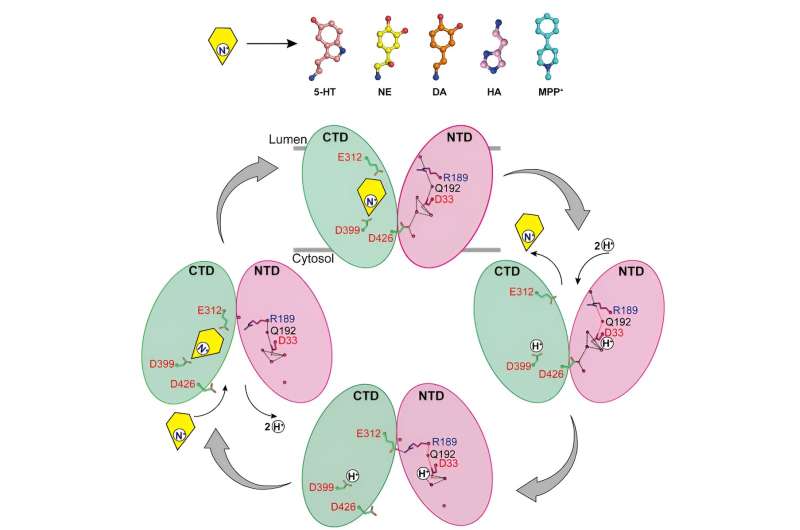
De onderzoekers rapporteerden de structuren van de binding van noradrenaline aan VMAT2 in verschillende conformaties, waaronder de naar het cytosol gerichte en naar het blaasje gerichte conformaties.
Ondanks significante conformationele veranderingen in VMAT2 blijft de substraatbindende pocket voor noradrenaline relatief stabiel tijdens dit proces, zonder significante veranderingen in interacties met omringende residuen. Deze slimme conformationele transitie is cruciaal voor het functioneren van VMAT2.
Door de structuren van VMAT2 bij verschillende pH-omstandigheden te analyseren, werd bevestigd dat D33 mogelijk een andere belangrijke protonatieplaats is.
Door de mechanismen waarmee VMAT2 verschillende structureel diverse monoamine-neurotransmitters en neurotoxinen herkent grondig te analyseren, stelt dit werk een moleculair model voor VMAT2-conformatieveranderingen voor en verfijnt het het specifieke mechanisme van proton-gekoppeld substraattransport verder.
Deze bevindingen bieden waardevolle inzichten voor een alomvattend begrip van de VMAT2-transportmodus, verrijken het kennissysteem van de belangrijkste facilitator van substraattransport uit de superfamilie en leggen een belangrijke basis voor de ontwikkeling en optimalisatie van geneesmiddelen.