
Wetenschap
Zee-egels op bestelling gemaakt:wetenschappers maken transgene doorbraak
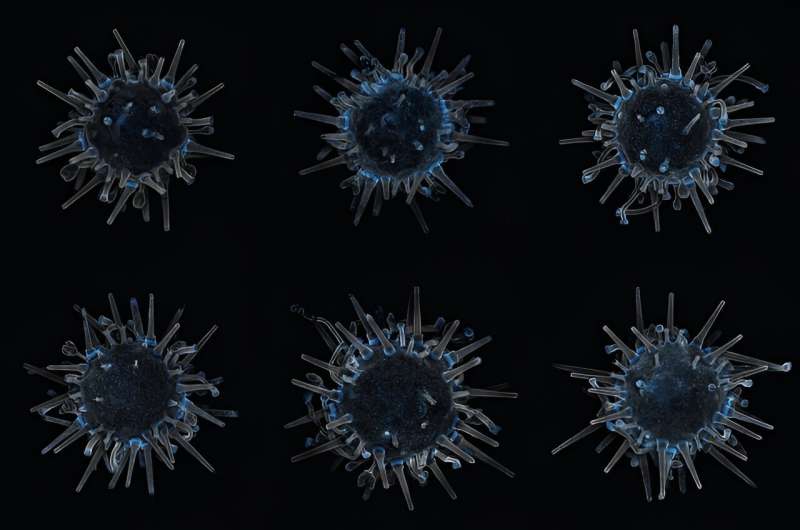
Denk eens aan de zee-egel. In het bijzonder de geschilderde zee-egel:Lytechinus pictus, een stekelige pingpongbal uit de oostelijke Stille Oceaan.
De soort is een kleinere en kortere neef van de paarse egels die kelpbossen verslinden. Ze produceren enorme aantallen sperma en eieren die buiten hun lichaam worden bevrucht, waardoor wetenschappers het proces van het ontstaan van zee-egels van dichtbij en op grote schaal kunnen bekijken. De ene generatie leidt binnen vier tot zes maanden tot de volgende. Ze delen meer genetisch materiaal met mensen dan fruitvliegjes en kunnen niet wegvliegen – kortom een ideaal proefdier voor de ontwikkelingsbioloog.
Wetenschappers gebruiken zee-egels al ongeveer 150 jaar om de celontwikkeling te bestuderen. Ondanks de status van zee-egels als superreproducers, dwingen praktische problemen wetenschappers er vaak toe hun werk te concentreren op gemakkelijker toegankelijke dieren:muizen, fruitvliegjes, wormen.
Wetenschappers die met muizen werken, kunnen bijvoorbeeld online dieren bestellen met de specifieke genetische eigenschappen die ze hopen te bestuderen:transgene dieren, waarvan de genen kunstmatig zijn gemanipuleerd om bepaalde eigenschappen tot uitdrukking te brengen of te onderdrukken.
Onderzoekers die met zee-egels werken, zijn doorgaans een deel van hun jaar bezig met het verzamelen ervan uit de oceaan.
"Kun je je voorstellen dat muizenonderzoekers elke nacht een muizenval zouden plaatsen, en wat ze ook zouden vangen, dat zouden ze bestuderen?" zei Amro Hamdoun, een professor aan de Scripps Institution of Oceanography van UC San Diego.
Ongewervelde zeedieren vertegenwoordigen ongeveer 40% van de biologische diversiteit van de dierenwereld, maar komen toch voor in een schamele fractie van een percentage van de dierstudies. Wat als onderzoekers net zo gemakkelijk toegang zouden krijgen tot zee-egels als muizen? Wat als het mogelijk zou zijn om lijnen van transgene egels te maken en groot te brengen?
Hoeveel kunnen we nog leren over hoe het leven werkt?
‘Weet je hoe iedereen tijdens de pandemie zuurdesem maakte? Ik ben niet goed in zuurdesem maken’, zei Hamdoun onlangs op zijn kantoor in Scripps’ Hubbs Hall. In plaats daarvan richtte hij zijn zinnen op een ander soort project:een nieuw transgeen proefdier, 'een fruitvlieg uit de zee'.
In maart publiceerde het laboratorium van Hamdoun een artikel over de bioRxiv preprint-server die de succesvolle invoeging demonstreert van een stukje vreemd DNA (in het bijzonder een fluorescerend eiwit van een kwal) in het genoom van een geschilderde zee-egel die de verandering doorgeeft aan zijn nakomelingen.
Het resultaat is de eerste transgene zee-egel, een zee-egel die onder tl-licht oplicht als een kerstlamp. (Het artikel is ingediend voor peer review.)
De dieren zijn de eerste transgene stekelhuidigen, de stam die zeesterren, zeekomkommers en andere zeedieren omvat. De missie van Hamdoun is om genetisch gemodificeerde zee-egels overal ter beschikking te stellen aan onderzoekers, en niet alleen aan degenen die toevallig in onderzoeksfaciliteiten aan de rand van de Stille Oceaan werken.
"Als je naar enkele van de andere modelorganismen kijkt, zoals Drosophila [fruitvliegjes], zebravissen en muizen, zijn er gevestigde informatiecentra", zegt Elliot Jackson, een postdoctoraal onderzoeker bij Scripps en hoofdauteur van het artikel. "Als je een transgene lijn wilt die het zenuwstelsel labelt, kun je die waarschijnlijk krijgen. Je zou die kunnen bestellen. En dat is wat we hopen dat we kunnen zijn voor zee-egels."
De mogelijkheid om een dier genetisch te modificeren vergroot wat wetenschappers ervan kunnen leren, met implicaties die veel verder gaan dan welke individuele soort dan ook.
"Het zal zee-egels transformeren als een model voor het begrijpen van de neurobiologie, voor het begrijpen van ontwikkelingsbiologie, voor het begrijpen van toxicologie", zegt Christopher Lowe, een Stanford-professor in de biologie die niet bij het onderzoek betrokken was.
De doorbraak van het laboratorium, en de focus op het vrij beschikbaar maken van de dieren voor collega-wetenschappers, zal "ons in staat stellen te onderzoeken hoe de evolutie een heleboel echt ingewikkelde levensproblemen heeft opgelost", zei hij.
Onderzoekers hebben de neiging muizen, vliegen en dergelijke te bestuderen, niet omdat de biologie van de dieren het meest geschikt is om hun vragen te beantwoorden, maar omdat "alle hulpmiddelen die nodig waren om je vragen te beantwoorden, in slechts een paar soorten waren opgebouwd", zei Deirdre Lyons. , universitair hoofddocent biologie bij Scripps, die met Hamdoun samenwerkte aan vroeg onderzoek met betrekking tot het project.
Het uitbreiden van het aanbod aan dieren dat beschikbaar is voor geavanceerd laboratoriumwerk is als het toevoegen van kleuren aan het palet van een kunstenaar, zei Lyons:"Nu kun je de kleur gaan krijgen die je echt wilt, die het beste bij je visie past, in plaats van vast te zitten aan een paar modellen. "
Op de begane grond van Hamdouns kantoorgebouw bevindt zich het experimentele aquarium Hubbs Hall, een garageachtige ruimte vol met tanks vol recirculerend zeewater en een bont assortiment aan zeeleven.
Tijdens een recent bezoek greep Hamdoun in een tank en maakte voorzichtig een geschilderde zee-egel los. Hij zoefde met verrassende snelheid over een uitgestrekte handpalm, alsof hij buitenaards terrein verkende.
De laatste gemeenschappelijke voorouder van L. pictus en Homo sapiens leefde minstens 550 miljoen jaar geleden. Ondanks de verschillende evolutionaire paden die we sindsdien hebben afgelegd, onthullen onze genomen een gedeeld biologisch erfgoed.
De genetische instructies die de transformatie van een enkele zygoot in een levend lichaam aandrijven, zijn opvallend vergelijkbaar bij onze twee soorten. Gespecialiseerde systemen onderscheiden zich van een enkele bevruchte eicel en de vertaling van een wirwar van eiwitten in een enkel levend wezen. Op cellulair niveau verloopt dat allemaal op vrijwel dezelfde manier voor zee-egels en mensen.
Deze dieren zijn "echt van fundamenteel belang voor ons begrip van al het leven", zei Hamdoun, terwijl hij de jongen terug in zijn aquarium plaatste. "En historisch gezien genetisch zeer ontoegankelijk."
Het experimentele aquarium werd gebouwd in de jaren zeventig, toen het opscheppen van leven uit de zee de enige manier was om onderzoeksspecimens te bemachtigen. Een paar verdiepingen hoger in Hubbs Hall ging Hamdoun voorop naar de egelkwekerij – de eerste grootschalige poging om opeenvolgende generaties dieren in een laboratorium groot te brengen. Op elk moment beschikt het team over 1.000 tot 2.000 zee-egels in verschillende ontwikkelingsstadia.
Rij na rij kleine plastic bakken stonden tegen een muur, elk met daarin een jonge egel ter grootte van een linze. Een strookje tape op elke tank vermeldde de genetische modificatie van het dier en de datum van bevruchting. Bij sommigen gaf een tweede stukje tape dieren aan die de wijziging in het DNA van hun geslachtscellen hadden, wat betekende dat deze kon worden doorgegeven aan het nageslacht. (Om deze reden houdt het laboratorium zijn egels nauwgezet gescheiden van de wilde populatie.)
"Een van de grote vragen in de hele biologie is begrijpen hoe de reeks instructies in het genoom je het fenotype geeft dat je wilt bestuderen," zei Hamdoun - in wezen hoe de reeks aminozuren die de genetische code van een dier is, aanleiding geeft tot aan de kenmerken van het levende, ademende wezen. "Een van de fundamentele dingen die je moet doen is dat genoom kunnen aanpassen en dan bestuderen wat de uitkomst is."
Hij wees naar een tank met daarin een klein zee-egeltje waarvan de genetische code het eiwit ABCD1 is afgeknipt.
ABCD1 fungeert als een uitsmijter, legde Hamdoun uit, parkeert langs het celmembraan en werpt vreemde moleculen uit. De werking van het eiwit kan de cel beschermen tegen schadelijke stoffen, maar kan soms in strijd zijn met het belang van een organisme, bijvoorbeeld wanneer het verhindert dat de cel een noodzakelijk medicijn opneemt.
Onderzoekers die gebruik maken van zee-egels waarin dat eiwit niet meer werkt, kunnen de beweging van een molecuul door een organisme bestuderen (DDT bijvoorbeeld) en meten hoeveel van de stof in de cel terechtkomt zonder de verstorende interferentie van ABCD1. Ze kunnen reverse-engineeren hoe groot de rol is die ABCD1 speelt bij het voorkomen dat een cel een medicijn absorbeert.
En dan zijn er nog de fluorescerende egels.
"De magie gebeurt in deze kamer", zei Jackson, terwijl hij een smal kantoor binnenliep met aan de ene kant microscopen ter waarde van $1 miljoen en aan de andere kant een tientallen jaren oude handbediende centrifuge die aan een tafel was vastgeschroefd.
Hij plaatste een petrischaaltje met drie transgene zee-egels ter grootte van een potloodgum onder een microscoop. Met een afmeting van 120 keer zo groot leken ze allemaal op de tot leven gekomen New Year's Eve-bal op Times Square:een gloeiend, wiebelend wezen met pentamere radiale symmetrie.
Fluorescentie is niet alleen een stekelhuidige feesttruc. Door de cellen te verlichten, kunnen onderzoekers hun bewegingen in een zich ontwikkelend organisme gemakkelijker volgen. Onderzoekers kunnen toekijken hoe de vroege cellen van een blastula zich delen en reorganiseren in neuraal of hartweefsel. Uiteindelijk zullen wetenschappers individuele genen kunnen uitschakelen en zien hoe dat de ontwikkeling beïnvloedt. Het zal ons helpen begrijpen hoe onze eigen soort zich ontwikkelt, en waarom die ontwikkeling niet altijd volgens plan verloopt.
Het laboratorium heeft "geweldig werk verricht. Het wordt door de gemeenschap zeer verwelkomd", zegt Marko Horb, senior wetenschapper en directeur van de National Xenopus Resource van het Marine Biological Laboratory van de Universiteit van Chicago.
Horb leidt het nationale uitwisselingscentrum voor genetisch gemodificeerde soorten Xenopus, een klauwkikker die wordt gebruikt in laboratoriumonderzoek. Het centrum ontwikkelt lijnen van transgene kikkers voor wetenschappelijk gebruik en distribueert deze onder onderzoekers.
Hamdoun stelt zich een soortgelijk informatiecentrum voor de egels van zijn laboratorium voor. Ze zijn al begonnen met het sturen van kleine flesjes met sperma van transgene zee-egels naar geïnteresseerde wetenschappers, die op maat gemaakte egels kunnen kweken met eieren die ze hebben verkregen uit het laboratorium van Hamdoun of uit een andere bron.
Hamdoun herinnert zich levendig de tijd die hij eerder in zijn carrière besteedde aan het opsporen van willekeurige stukjes DNA die nodig waren voor zijn onderzoek, de teleurstelling en frustratie van het schrijven naar professoren en voormalige postdocs om vervolgens te ontdekken dat het materiaal al lang verloren was gegaan. Hij heeft liever dat toekomstige generaties wetenschappers hun tijd besteden aan ontdekkingen.
"Biologie is echt interessant," zei hij. "Hoe meer mensen er toegang toe krijgen, hoe meer we gaan leren."