
Wetenschap
Mitochondriale omzetting:onderzoekers ontdekken waardoor celbatterijen leegraken
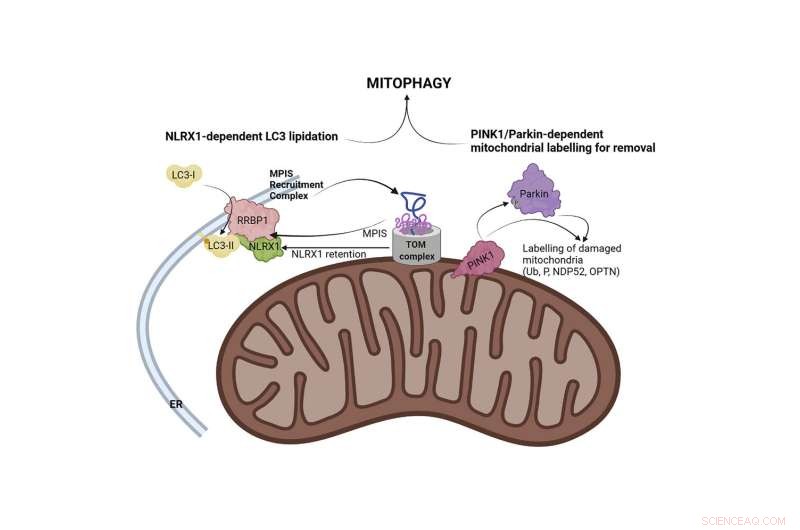
Grafisch abstract. Krediet:Moleculaire cel (2022). DOI:10.1016/j.molcel.2022.06.004
Onderzoekers van de Universiteit van Toronto hebben ontdekt hoe mitochondriale omzetting - een cruciale cellulaire functie - begint.
Mitochondriën zijn als de batterijen van ons lichaam. Het zijn vitale energiebronnen voor cellen en zijn nodig om de functie in bijna alle celtypen te reguleren. En, net als batterijen, moeten mitochondriën worden vervangen als ze na verloop van tijd leeg raken. Als deze celbatterijen niet efficiënt worden vervangen en niet goed draaien, ervaren cellen stress en kunnen ze afsterven.
Gezonde mitochondriën zijn op hun beurt van cruciaal belang in energievragende organen zoals de hersenen en spieren. Wanneer dit afbraakproces wordt verstoord, kunnen kwetsbare neuronen afsterven. Dit type verstoring is aanwezig bij veel neurodegeneratieve ziekten zoals Parkinson.
Nu toont een onderzoek door Stephen Girardin, een professor in laboratoriumgeneeskunde en pathobiologie aan de Temerty Faculteit der Geneeskunde, en postdoctoraal onderzoeker Samuel Killackey aan dat wanneer bepaalde nucleair gecodeerde eiwitten niet in de mitochondriën worden gebracht, de mitochondriën worden verwijderd.
"We zijn er trots op dat we het probleem hebben geïdentificeerd en vooruitgang hebben geboekt bij het begrijpen en karakteriseren van de moleculaire spelers en paden, en hoe dit allemaal in een cel is geïntegreerd - op een aantal verrassende manieren", zegt Giradin.
Girardin bestudeert een mitochondriale Nod-like receptor (NLR) genaamd NLRX1. Hoewel NLRX1 betrokken is geweest bij diverse cellulaire processen, bleef de onderliggende functie tot nu toe ongrijpbaar voor onderzoekers.
Over het algemeen draaide onderzoek op dit gebied rond depolarisatie - het verlies van elektrisch potentieel over het binnenste mitochondriale membraan - als het belangrijkste signaal voor mitochondriale verwijdering.
De studie van Girardin en Killackey toonde ook aan dat depolarisatie een stroomopwaartse oorzaak is van beperkte mitochondriale eiwitimport.
De bevindingen, gepubliceerd in Molecular Cell , nieuwe wegen openen voor onderzoek naar ziekten waarbij de mitochondriale stabiliteit verloren gaat.
"Dit vertelt ons dat het probleem zich voordoet wanneer de eiwitimport mislukt en de cel een signaal ontvangt van de defecte import van het mitochondriale eiwit, NLRX1. Dit is het teken om de mitochondriën te vernietigen, een proces dat bekend staat als mitofagie", zegt Girardin.
Door het proces vanuit een ander perspectief te bekijken, toonde het team aan dat de gevestigde wetenschap op dit gebied niet het hele plaatje liet zien.
"We hebben een stap terug gedaan en enkele punten in de literatuur met elkaar verbonden, wat ons hielp te identificeren dat verstoorde eiwitimport een gemeenschappelijke noemer was van veel mitochondriale stressoren die mitofagie veroorzaken", zegt Killackey, een Vanier Scholar die het onderzoek uitvoerde tijdens zijn Ph. .D. onderzoeken in het laboratorium van Girardin.
De ontdekking maakt de weg vrij voor onderzoekers om de rol van mitochondriale disfunctie bij ziekten en in metabolisch actieve organen zoals de hersenen, het hart en de nieren verder te onderzoeken.
"We hebben een rol gezien voor NLRX1-gedreven mitofagie in spierfunctie gemeten door middel van uithoudingsvermogen, wat implicaties zou kunnen hebben voor ziekten die spieratrofie of functionele tekorten met zich meebrengen. Het aanpassen van de omvang en efficiëntie van mitochondriale eiwitimport zou ook therapeutisch voordeel kunnen bieden voor neurodegeneratieve ziekte", zegt Killackey.
De bevindingen zijn het hoogtepunt van 15 jaar onderzoek, een mijlpaal voor Girardin.
"Ik hou van fundamentele vragen", zegt hij. "Wat er daarna met de kennis gebeurt, is een kwestie van fysiologie, translationele geneeskunde of medicijnontwikkeling. Dus nu is het tijd om het stokje door te geven aan anderen, of om samen te werken met enthousiaste medewerkers." + Verder verkennen
Nieuwe verouderingsgerelateerde moleculaire route ontdekt
 Hoe het percentage van de concentratie koper sulfaat in koper sulfaat pentahydraat te vinden
Hoe het percentage van de concentratie koper sulfaat in koper sulfaat pentahydraat te vinden Bonddissociatie-energieën voor overgangsmetaalsiliciden nauwkeurig bepaald
Bonddissociatie-energieën voor overgangsmetaalsiliciden nauwkeurig bepaald Transistorfabricage op gebogen oppervlak betekent wenden tot betere diabetestherapie
Transistorfabricage op gebogen oppervlak betekent wenden tot betere diabetestherapie Neutronen turen in een draaiende motor
Neutronen turen in een draaiende motor Waarom maakt steenzout ijskoud?
Waarom maakt steenzout ijskoud?
 Slechts acht EU-landen om steenkool tegen 2030 uit te faseren
Slechts acht EU-landen om steenkool tegen 2030 uit te faseren Wat zijn de trofische niveaus in ons ecosysteem?
Wat zijn de trofische niveaus in ons ecosysteem?  Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten
Menselijk afvalwater waardevol voor de wereldwijde landbouw, economie, studie vondsten Biden lanceert plan om stille moordenaar aan te pakken:extreme hitte
Biden lanceert plan om stille moordenaar aan te pakken:extreme hitte Gevaarlijk vuurseizoen doemt op terwijl het door droogte geteisterde westen van de VS op weg is naar een watercrisis
Gevaarlijk vuurseizoen doemt op terwijl het door droogte geteisterde westen van de VS op weg is naar een watercrisis
Hoofdlijnen
- Decennia lang onderzoek wijst uit dat bedreigde walvissen minder baby's krijgen
- Behandeling voor honden verlicht de angst voor lawaaierig vuurwerk
- Gesteenten beïnvloeden aangrenzende bodems en plantengroei op fijne schalen in karstgebieden
- Microalgen beloven overvloedig gezond voedsel en voer in elke omgeving
- Verschillen tussen een neuron en een neuroglia
- Research Paper Topics in Biochemistry
- Lijst met genotypes
- Welk proces voeren Ribosomes uit?
- 5 waargebeurde verhalen over een bij de geboorte gescheiden tweeling
- Sahelanthropus, de oudste vertegenwoordiger van de mensheid, was inderdaad tweevoetig
- Wetenschappers visualiseren de structuur van de belangrijkste DNA-reparatiecomponent met een bijna-atomaire resolutie
- Wetenschappers lokaliseren jaloezie in de monogame geest

- Hartmonitors op wilde narwallen onthullen alarmerende reacties op stress

- Wetenschappers ontdekken boodschapper-RNA met twee functies
 Kunnen congestietarieven mijn woon-werkverkeer helpen?
Kunnen congestietarieven mijn woon-werkverkeer helpen?  Winst Nintendo eerste kwartaal met 44 pct gestegen tot $ 275 miljoen op Switch-verkopen
Winst Nintendo eerste kwartaal met 44 pct gestegen tot $ 275 miljoen op Switch-verkopen Elektronenmicroscopie geeft aanwijzingen over de kleurrijke chemie van libellenvleugels
Elektronenmicroscopie geeft aanwijzingen over de kleurrijke chemie van libellenvleugels Wetenschappers ontwerpen nanovallen om te vangen, duidelijk coronavirus
Wetenschappers ontwerpen nanovallen om te vangen, duidelijk coronavirus Sporen van de vroege magma-oceaan van de aarde geïdentificeerd in Groenlandse rotsen
Sporen van de vroege magma-oceaan van de aarde geïdentificeerd in Groenlandse rotsen Kan draadloze uitdagingskabel voor thuisinternetservice?
Kan draadloze uitdagingskabel voor thuisinternetservice? Inzicht in interfaces van hybride materialen met machine learning
Inzicht in interfaces van hybride materialen met machine learning 30 doden door bosbranden in Portugal en Spanje
30 doden door bosbranden in Portugal en Spanje
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

