Wetenschap
Onderzoeksteam onderzoekt de rupsachtige bacteriën die in onze mond kruipen
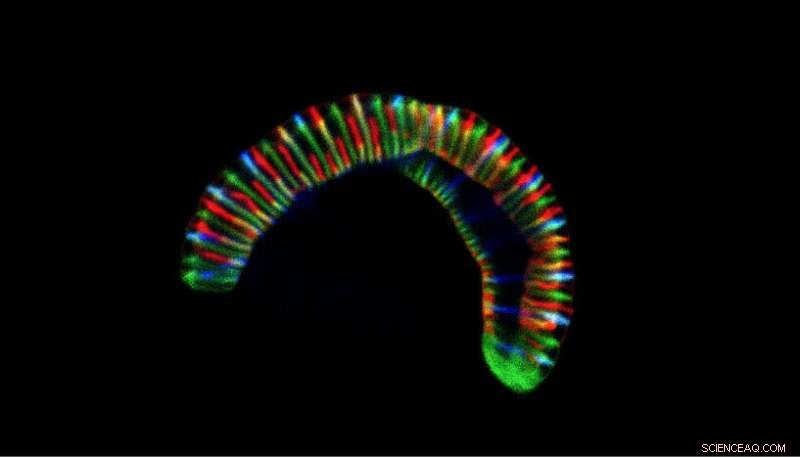
Confocale microscoopopname van de rupsachtige bacterie Conchiformibius steedae, tot 7 µm lang, geïncubeerd met fluorescent gelabelde celwandprecursoren om de celgroei te volgen. Krediet:CC BY 4.0 / Philipp Weber en Silvia Bulgheresi
Waarschijnlijk overleven bacteriën in de mondholte en zijn ze geëvolueerd om zich langs hun lengteas te delen zonder van elkaar te scheiden. Een onderzoeksteam onder leiding van milieucelbioloog Silvia Bulgheresi van de Universiteit van Wenen en microbieel geneticus Frédéric Veyrier van het Institut national de la recherche scientifique (INRS) heeft zojuist hun nieuwe inzichten gepubliceerd in Nature Communications . In hun werk beschreven ze de delingsmodus van deze rupsachtige bacteriën en hun evolutie van een staafvormige voorouder. Ze stellen voor om orale bacteriën van Neisseriaceae te vestigen als nieuwe modelorganismen die kunnen helpen bij het opsporen van nieuwe antimicrobiële doelen.
Hoewel onze mond meer dan 700 soorten bacteriën herbergt en de microbiota net zo divers is als die van onze darm, is er niet veel bekend over hoe orale bacteriën groeien en delen. De mond is een moeilijke plek om in te leven voor bacteriën. De epitheelcellen die het binnenoppervlak van de mondholte bekleden, worden constant afgestoten, en samen met de speekselstroom zullen organismen die dit oppervlak bewonen daarom worstelen om hechting.
Het is mogelijk dat bacteriën van de familie Neisseriaceae, om beter aan onze mond te blijven plakken, een nieuwe manier hebben ontwikkeld om zich te vermenigvuldigen. Terwijl typische staafjes zich transversaal splitsen en dan van elkaar loskomen, hechten sommige commensale Neisseriaceae die in onze mond leven zich echter met hun punten aan het substraat en verdelen zich in de lengterichting - langs hun lange as. Bovendien blijven ze, als de celdeling eenmaal is voltooid, aan elkaar gehecht en vormen ze rupsachtige filamenten. Sommige cellen in het resulterende filament nemen ook verschillende vormen aan, mogelijk om specifieke functies uit te voeren ten voordele van het hele filament. De onderzoekers leggen uit:"Multicellulariteit maakt samenwerking tussen cellen mogelijk, bijvoorbeeld in de vorm van arbeidsdeling, en kan daardoor bacteriën helpen om voedingsstress te overleven."
Het team van onderzoekers gebruikte eerst elektronenmicroscopie om, in de Neisseriaceae-familie, bacteriële celvormen te onderzoeken die de twee standaard celvormen (staaf en coccus) bevatten naast de rupsachtige filamenten. Door hun celvormen en genomen in de Neisseriaceae-familie te vergelijken, konden de onderzoekers concluderen dat de meercellige, longitudinaal delende bacteriën evolueerden uit staafvormige, transversaal delende bacteriën. Bovendien konden ze vaststellen welke genen waarschijnlijk verantwoordelijk waren voor de ongebruikelijke vermenigvuldigingsstrategie.
Ze gebruikten vervolgens fluorescentie-labeltechnieken om de voortgang van celgroei in de meercellige bacteriën te visualiseren en vergeleken uiteindelijk de genetische samenstelling hiervan met "klassieke" staafvormige soorten. Ten slotte probeerden ze die evolutie na te bootsen door de genetische veranderingen in staafvormige Neisseriaceae te introduceren. Hoewel ze staafvormige bacteriën niet konden dwingen om meercellig te worden, resulteerde genetische manipulatie in langere en dunnere cellen. "We speculeren dat in de loop van de evolutie, door een herwerking van de verlengings- en delingsprocessen, de celvorm veranderde, misschien om beter te gedijen in de mondholte", zei Frédéric Veyrier.
"Behalve dat het ons helpt te begrijpen hoe de celvorm evolueerde, kan meercellige Neisseriaceae nuttig zijn om te bestuderen hoe bacteriën hebben leren leven, gehecht aan het oppervlak van dieren, de enige plaats waar ze tot nu toe zijn gevonden. De helft van ons draagt ze in onze mond trouwens", legt Silvia Bulgheresi uit van de afdeling Functionele en Evolutionaire Ecologie van de Universiteit van Wenen.
Philipp Weber van de Universiteit van Wenen, Ph.D., een student in het team van Bulgheresi die ook aan het onderzoek heeft gewerkt, benadrukt echter dat "het uitbreiden van het celbiologische veld naar aanvullende morfologieën en symbiotische soorten ook cruciaal is om de hoeveelheid eiwit te vergroten doelen (bijv. antibioticadoelen) voor biofarmaceutische toepassingen."
Sammy Nyongesa, een Ph.D. student in Veyrier's team van INRS, voegt toe:"Een evolutionaire benadering, zoals die hier voor de Neisseriaceae wordt uitgevoerd, kan licht werpen op nieuwe, onvoorziene eiwitdoelen." + Verder verkennen
Onconventionele celdeling in de Caribische Zee
 Onderzoeksteam brengt nieuwe wereldwijde grondwaterkaarten uit
Onderzoeksteam brengt nieuwe wereldwijde grondwaterkaarten uit Soorten spinnen: zwart met witte stippen
Soorten spinnen: zwart met witte stippen Glasvezel gebruikt om de temperatuur van de Groenlandse ijskap te meten
Glasvezel gebruikt om de temperatuur van de Groenlandse ijskap te meten Verontwaardiging over wetsvoorstel in Brazilië om milieuregels te versoepelen
Verontwaardiging over wetsvoorstel in Brazilië om milieuregels te versoepelen Brexit bedreigt klimaatactie van de EU, uit onderzoek blijkt
Brexit bedreigt klimaatactie van de EU, uit onderzoek blijkt
Hoofdlijnen
- Handelen of niet handelen? De ivoren impasse doorbreken
- Welk bewijs is aanwezig Prokaryoten bestonden vóór eukaryoten?
- DNA-ontdekking kan licht werpen op zeldzame kinderziekte
- Warmere aarde kan kleinere vlinders zien die moeite hebben om te vliegen, waardoor voedselsystemen worden aangetast
- Dammen en andere barrières voor paaigebieden voor zalm zorgen voor uitdagingen voor visserijbeheerders
- Het verhaal van evolutie geschreven in fosfor
- Wetenschapsprojecten: roken en de gevolgen ervan op de longen
- Hoe polyfasische slaap werkt
- Waarom zijn er geen zeeslangen in de Atlantische Oceaan?
 Er is een wereldwijde toiletrevolutie aan de gang, maar het vervuilt het water en negeert de stedelijke armen
Er is een wereldwijde toiletrevolutie aan de gang, maar het vervuilt het water en negeert de stedelijke armen Kubieke voeten converteren naar Lbs
Kubieke voeten converteren naar Lbs  Samsung-dongle-lek suggereert dat de fabrikant van de smartphone de koptelefoonaansluiting doodt
Samsung-dongle-lek suggereert dat de fabrikant van de smartphone de koptelefoonaansluiting doodt Een eerste blik op thermostaatoorlogen suggereert dat vrouwen deze gevechten misschien aan het verliezen zijn
Een eerste blik op thermostaatoorlogen suggereert dat vrouwen deze gevechten misschien aan het verliezen zijn Naakte buitenaardse wezens
Naakte buitenaardse wezens  Tesla cash burn versnelt, CEO voorspelt winst vooruit (Update)
Tesla cash burn versnelt, CEO voorspelt winst vooruit (Update) Hoe oplopende crises in 2020 leidden tot recordhoge wapenverkopen
Hoe oplopende crises in 2020 leidden tot recordhoge wapenverkopen Apple heeft er 8 dagen over gedaan om me de gegevens te geven die het over mij had verzameld. Het was een eye-opener.
Apple heeft er 8 dagen over gedaan om me de gegevens te geven die het over mij had verzameld. Het was een eye-opener.
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com