Wetenschap
Onderzoekers ontwikkelen CRISPR om enkele RNA-letters in menselijke cellen te bewerken
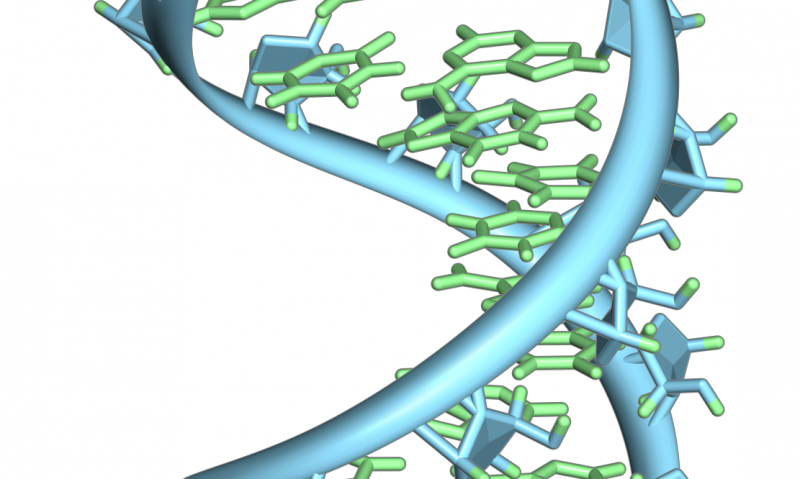
Een haarspeldlus van een pre-mRNA. Gemarkeerd zijn de nucleobasen (groen) en de ribose-fosfaatruggengraat (blauw). Merk op dat dit een enkele streng RNA is die zich op zichzelf terugvouwt. Krediet:Vossman/Wikipedia
Wetenschappers van het Broad Institute en MIT die CRISPR voor het eerst gebruikten voor het bewerken van het genoom van zoogdieren, hebben een nieuw moleculair systeem ontwikkeld voor het efficiënt bewerken van RNA in menselijke cellen. RNA-bewerking, die genproducten kunnen veranderen zonder veranderingen in het genoom aan te brengen, heeft een enorm potentieel als instrument voor zowel onderzoek als ziektebehandeling.
In een artikel dat vandaag is gepubliceerd in Wetenschap , senior auteur Feng Zhang en zijn team beschrijven het nieuwe op CRISPR gebaseerde systeem, genaamd RNA-editing voor programmeerbare A tot I-vervanging, of "REPARATIE". Het systeem kan enkele RNA-nucleosiden in zoogdiercellen op een programmeerbare en precieze manier veranderen. REPAIR heeft het vermogen om ziekteverwekkende mutaties op RNA-niveau om te keren, evenals andere potentiële therapeutische en fundamentele wetenschappelijke toepassingen.
"Het vermogen om ziekteverwekkende mutaties te corrigeren is een van de belangrijkste doelen van genoombewerking, " zei Zhang, een kerninstituutlid bij het Broad Institute en onderzoeker bij het McGovern Institute for Brain Research aan het MIT. "Tot dusver, we zijn erg goed geworden in het inactiveren van genen, maar eigenlijk is het herstellen van de verloren eiwitfunctie veel uitdagender. Deze nieuwe mogelijkheid om RNA te bewerken, opent meer potentiële mogelijkheden om die functie te herstellen en vele ziekten te behandelen, in bijna elke soort cel."
REPAIR heeft de mogelijkheid om individuele RNA-letters te targeten, of nucleosiden, adenosines omschakelen naar inosines (door de cel gelezen als guanosines). Deze letters zijn betrokken bij veranderingen op een enkele basis waarvan bekend is dat ze regelmatig ziekten bij mensen veroorzaken. Bij menselijke ziekten, een mutatie van G naar A komt zeer vaak voor; deze wijzigingen zijn betrokken bij, bijvoorbeeld, gevallen van focale epilepsie, Duchenne spierdystrofie, en de ziekte van Parkinson. REPAIR heeft het vermogen om de impact van elke pathogene G-naar-A-mutatie ongedaan te maken, ongeacht de omringende nucleotidesequentie, met het potentieel om in elk celtype te werken.
In tegenstelling tot de permanente veranderingen in het genoom die nodig zijn voor DNA-bewerking, RNA-bewerking biedt een veiliger, flexibelere manier om correcties in de cel aan te brengen. "REPAIR kan mutaties repareren zonder te knoeien met het genoom, en omdat RNA van nature afbreekt, het is een potentieel omkeerbare oplossing, " legde co-eerste auteur David Cox uit, een afgestudeerde student in het lab van Zhang.
Om REPARATIE aan te maken, de onderzoekers hebben de CRISPR-Cas13-enzymfamilie systematisch geprofileerd voor potentiële "editor" -kandidaten (in tegenstelling tot Cas9, de Cas13-eiwitten richten en knippen RNA). Ze selecteerden een enzym uit de Prevotella-bacterie, genaamd PspCas13b, die het meest effectief was bij het inactiveren van RNA. Het team ontwikkelde een gedeactiveerde variant van PspCas13b die nog steeds bindt aan specifieke stukken RNA, maar zijn "schaarachtige" activiteit mist. en fuseerde het tot een eiwit genaamd ADAR2, die de nucleoside adenosine verandert in inosine in RNA-transcripten.
In reparatie, het gedeactiveerde Cas13b-enzym zoekt een doelsequentie van RNA, en het ADAR2-element voert de nucleosideconversie uit zonder het transcript te snijden of te vertrouwen op een van de natieve machinerie van de cel.
Het team heeft het bewerkingssysteem verder aangepast om de specificiteit te verbeteren, het verminderen van detecteerbare off-target bewerkingen van 18, 385 tot slechts 20 in het hele transcriptoom. De verbeterde incarnatie, REPARATIEv2, bereikte consequent de gewenste bewerking in 20 tot 40 procent - en tot 51 procent - van een gericht RNA zonder tekenen van significante activiteit buiten het doel. "Het succes dat we hadden bij het ontwikkelen van dit systeem is bemoedigend, en er zijn duidelijke tekenen dat REPAIRv2 nog verder kan worden ontwikkeld voor meer robuuste activiteit met behoud van specificiteit, " zei Omar Abudayyeh, co-eerste auteur en een afgestudeerde student in het lab van Zhang.
Om het therapeutische potentieel van REPAIR aan te tonen, het team synthetiseerde de pathogene mutaties die Fanconi-anemie en X-gebonden nefrogene diabetes insipidus veroorzaken, introduceerde ze in menselijke cellen, en corrigeerde deze mutaties met succes op RNA-niveau. Om de therapeutische vooruitzichten verder te duwen, het team is van plan om de efficiëntie van REPAIRv2 te verbeteren en het te verpakken in een leveringssysteem dat geschikt is om REPAIRv2 in specifieke weefsels in diermodellen te introduceren.
De onderzoekers werken ook aan aanvullende tools voor andere soorten nucleosideconversies. "Er is een enorme natuurlijke diversiteit in deze enzymen, " zei co-eerste auteur Jonathan Gootenberg, een afgestudeerde student in zowel het laboratorium van Zhang als het laboratorium van Aviv Regev, lid van het brede kerninstituut. "We zijn altijd op zoek naar de kracht van de natuur om deze veranderingen door te voeren."
Zhang, samen met het Broad Institute en MIT, plan om het REPAIR-systeem op grote schaal te delen. Net als bij eerdere CRISPR-tools, de groepen zullen deze technologie vrij beschikbaar stellen voor academisch onderzoek via de pagina van het Zhang-lab op de website voor het delen van plasmiden Addgene, waardoor het Zhang-lab al meer dan 42 reagentia heeft gedeeld, 000 keer met onderzoekers op meer dan 2, 200 laboratoria in 61 landen, onderzoek over de hele wereld versnellen.
 Hoe twee watermoleculen samen dansen
Hoe twee watermoleculen samen dansen Onderzoekers krijgen controle over de synthese van zachte moleculen
Onderzoekers krijgen controle over de synthese van zachte moleculen Hoe maak je een Bromothymol Blue Solution
Hoe maak je een Bromothymol Blue Solution  Onderzoekers gebruiken licht om snelle chemische reacties op een nieuwe manier te beheersen
Onderzoekers gebruiken licht om snelle chemische reacties op een nieuwe manier te beheersen Nieuw bewijs toont aan dat de eerste bouwstenen van het leven op aarde misschien rommeliger waren dan eerder werd gedacht
Nieuw bewijs toont aan dat de eerste bouwstenen van het leven op aarde misschien rommeliger waren dan eerder werd gedacht
 Wat betekent "Geografische locatie"?
Wat betekent "Geografische locatie"?  Recente trends in de opwarming van de aarde zijn niet in overeenstemming met een zeer hoge klimaatgevoeligheid
Recente trends in de opwarming van de aarde zijn niet in overeenstemming met een zeer hoge klimaatgevoeligheid Hoe promoot de VS onderzoek naar schone energie?
Hoe promoot de VS onderzoek naar schone energie?  Mangroven bedreigd door plasticvervuiling door rivieren, nieuwe studie vondsten
Mangroven bedreigd door plasticvervuiling door rivieren, nieuwe studie vondsten Hoe worden kristallen gemaakt?
Hoe worden kristallen gemaakt?
Hoofdlijnen
- Hoe slaap werkt
- Wanneer is lachen een medisch symptoom?
- Wetenschappers identificeren het verband tussen licht en chloroplastontwikkeling
- Een vogel in de bush is $223 waard, 851 in de hand
- Wanneer één referentiegenoom niet genoeg is
- Politieke instabiliteit en zwak bestuur leiden tot verlies van soorten, studie vondsten
- Insectencompound Oog versus Menselijk Oog
- Amfibieën redden van een dodelijke schimmel betekent handelen zonder alle antwoorden te weten
- Noordelijke maïsbladziekte-genen geïdentificeerd in nieuwe studie
 Algemene kenmerken van zuren en basen
Algemene kenmerken van zuren en basen Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat
Nieuwe studie suggereert dat de koolstofput op het land in de VS mogelijk is overschat Gevoelige nieuwe lasertechniek detecteert vluchtige organische stoffen
Gevoelige nieuwe lasertechniek detecteert vluchtige organische stoffen Science of Psyche:unieke asteroïde bevat aanwijzingen voor het vroege zonnestelsel
Science of Psyche:unieke asteroïde bevat aanwijzingen voor het vroege zonnestelsel Soorten aardwetenschappen
Soorten aardwetenschappen
De studie van de aarde, inclusief de formatie, bronnen, natuurlijke processen, geschiedenis en omgevingen, wordt aardwetenschappen of geowetenschap genoemd. Geoscientisten bestuderen ook andere planeten en het zonnestelsel
 Wetenschappers modelleren natuurlijke rotsarcades
Wetenschappers modelleren natuurlijke rotsarcades Nieuw boek legt uit hoe beroemde mummie werd vermoord
Nieuw boek legt uit hoe beroemde mummie werd vermoord Een nieuw raamwerk voor op visie gebaseerd agressief rijden
Een nieuw raamwerk voor op visie gebaseerd agressief rijden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com