
Wetenschap
Onderzoek toont aan hoe vrouwelijke immuuncellen hun tweede X-chromosoom uitgeschakeld houden
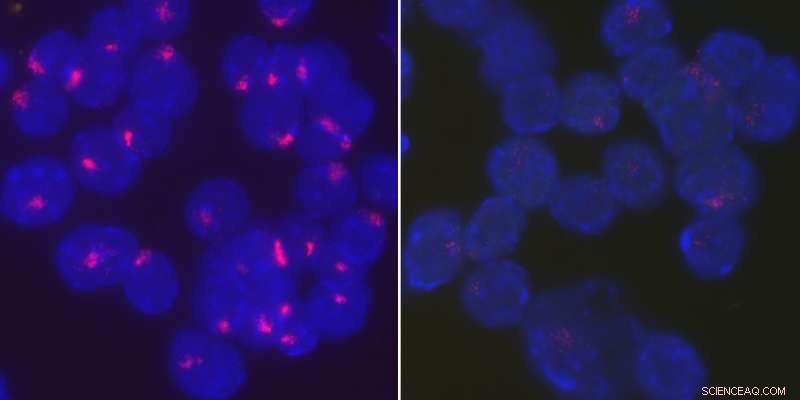
Onderzoekers ontdekten dat het eiwit YY1 Xist-RNA terugbrengt naar het inactieve X-chromosoom om de inactivatie van het X-chromosoom in gestimuleerde B-cellen te handhaven. geactiveerd, wildtype B-cellen van vrouwelijke muizen lokaliseren Xist RNA strak op hun inactieve X-chromosomen (links), terwijl Xist RNA door de hele kern wordt verspreid wanneer YY1 wordt verwijderd (rechts). Krediet:Universiteit van Pennsylvania
Auto-immuunziekten hebben de neiging om vrouwen meer te treffen dan mannen en het hebben van meerdere X-chromosomen kan de belangrijkste reden zijn waarom. Terwijl een proces dat X-chromosoominactivatie wordt genoemd, dient om de gendosering tussen mannen en vrouwen in evenwicht te brengen, sommige genen op het "inactieve X" -chromosoom in immuuncellen kunnen soms aan dit proces ontsnappen, vrouwen een extra dosis immuniteitsgerelateerde genexpressie geven.
In een nieuwe studie, een team van de Universiteit van Pennsylvania beschrijft hoe de inactivatie van het X-chromosoom wordt gereguleerd in de B-cellen van het immuunsysteem terwijl ze zich ontwikkelen in het beenmerg en wanneer ze antigenen tegenkomen. Hun werk belicht een dynamische, tweestapsmechanisme bij vrouwen waarbij B-cellen die de markers van X-chromosoominactivatie missen deze modificaties herwinnen tijdens B-celactivering, in een proces waarbij de transcriptiefactor YY1 betrokken is.
"Wat opmerkelijk is, is dat B-cellen degenen zijn die antilichamen en auto-antilichamen maken, dus ze zijn echt cruciaal in zowel beschermende immuunreacties als auto-immuniteit, " zei Montserrat C. Anguera, assistent-professor bij de afdeling Biomedische Wetenschappen van Penn's School of Veterinary Medicine en de senior auteur van het onderzoek. "Een grote vraag die overblijft is, Waarom zijn deze immuuncellen bezig met het voorbereiden van dit chromosoom om anders te worden gereguleerd en ook, Als deze processen mislopen, hoe leidt dat tot auto-immuniteit en verlies van zelftolerantie?"
De studie, gepubliceerd in PLOS Genetica , werd geleid door Camille M. Syrett, een doctoraatsstudent in het lab van Anguera. co-auteurs, die zowel Penn Vet als Penn's Perelman School of Medicine vertegenwoordigen, waren Vishal Sinhava, Suchita Hodawadekar, Arpita Myles, Guanxiang Liang, Yue Zhang, Satabdi Nandi, Michael Cancro en Michael Atchison.
In een onderzoek vorig jaar in het tijdschrift Proceedings van de National Academy of Sciences , Anguera en collega's vonden dat naïef, ongestimuleerde vrouwelijke lymfocyten, de B- en T-cellen van het immuunsysteem, slaagde er niet in om een X-chromosoom volledig te inactiveren. Uit het onderzoek bleek dat dit kwam doordat Xist, een lang niet-coderend RNA-transcript waarvan bekend is dat het het proces van X-chromosoominactivatie initieert en in stand houdt, niet gelokaliseerd op het inactieve X-chromosoom. Toen de immuuncellen werden geactiveerd, of klaar om te reageren op infectie, Xist RNA verscheen weer op de juiste plaats.
"We zagen dat de geïnactiveerde B-cellen deze RNA-wolk niet hebben, maar het komt terug bij stimulatie, " zei Syrett. "We waren echt geïnteresseerd in het bepalen wat het Xist-RNA terugbrengt."
Met behulp van een fluorescerende tracker-molecuul, het team begon met het volgen van de locatie van Xist in de ontwikkeling van B-cellen bij vrouwelijke muizen. Ze ontdekten dat de voorlopers van B-cellen, zoals hematopoëtische stamcellen en gemeenschappelijke lymfoïde voorlopers, had duidelijke patronen van Xist RNA op het inactieve X-chromosoom. Maar, aangezien deze voorlopers van B-cellen een ontwikkelingspad aflegden om B-cellen te worden, Xist RNA leek eerst te verdwijnen, dan weer verschijnen, maar alleen als diffuse speldenprikken over de kern in plaats van gelokaliseerd te zijn in de inactieve X.
In aanvulling, tags met kleine moleculen die heterochromatine-modificaties worden genoemd, waarvan bekend is dat ze genrepressie in stand houden tijdens de inactivatie van X-chromosomen, verdwenen tijdens de ontwikkeling van B-cellen.
"We konden deze echt ongebruikelijke veranderingen op chromatineniveau zien gebeuren in de ontwikkeling van vrouwelijke B-cellen, ' zei Anguera.
Om erachter te komen hoe de Xist terugkeerde naar de inactieve X na activering van de B-cel, zoals ze hadden aangetoond in de PNAS-paper van vorig jaar, de onderzoekers volgden Xist-RNA in B-cellen in kweek. Ze ontdekten dat de terugkeer plaatsvond in twee verschillende fasen:tussen vier en 16 uur nadat de cellen waren gestimuleerd, de spikkels van Xist RNA begonnen te verschijnen. En tussen 16 en 30 uur na stimulatie, Xist RNA concentreerde zich uitsluitend op het inactieve X-chromosoom. De heterochromatinemodificaties bleken ook in deze tweede fase toe te nemen en te lokaliseren op de inactieve X.
De eerdere studie van het team had erop gewezen dat het eiwit YY1 een rol speelt bij de terugkeer van Xist in geactiveerde B-cellen, dus begonnen ze er in dit werk nader naar te kijken. Atchison, een leider in studies van YY1 in B-celontwikkeling, kon zijn expertise lenen om de rol van het eiwit bij de inactivatie van het X-chromosoom te onderzoeken.
Toen de onderzoekers B-cellen van muizen zonder YY1 onderzochten, ze zagen sterk verminderde niveaus van heterochromatine-markeringen en minder lokalisatie van Xist-RNA naar de inactieve X.
Het team nam ook bewijs waar dat YY1 de expressie van X-chromosoomgenen beïnvloedde. Toen ze YY1 uit mannelijke en vrouwelijke cellen verwijderden en genen vergeleken die differentieel tot expressie werden gebracht op het X-chromosoom, ze vonden er 68 die specifiek waren voor vrouwen, een die specifiek was voor mannen en 11 die werden gedeeld.
Van de 68 genen die specifiek zijn voor vrouwen, veel waren gerelateerd aan immuniteit, en van ten minste twee is bekend dat ze tot overexpressie worden gebracht in menselijke vrouwelijke B-cellen in vergelijking met mannelijke B-cellen.
Een verdere reeks experimenten identificeerde het gebied van YY1 met DNA-bindende activiteit als het sleuteldomein van dit eiwit dat betrokken is bij het brengen van Xist-RNA naar het inactieve X.
"Het lijkt te werken als een ketting, het Xist-RNA samenbrengen met het DNA van het inactieve X-chromosoom, ' zei Anguera.
Zij en haar collega's zullen de rol van YY1 verder onderzoeken, met behulp van klinische monsters en muismodellen, om te kijken naar het eiwit in ziekten zoals lupus om hun begrip te verdiepen van hoe auto-immuniteit het gevolg zou kunnen zijn van het "ontsnappen" van immuungenen door inactivatie van X-chromosoom.
"Als je een therapie voor auto-immuunziekten wilt ontwikkelen, het idee is, Hoe krijgen we Xist op het inactieve X-chromosoom en houden we het daar zodat we de dosiscompensatie in deze B-cellen behouden", zei Anguera. "Zeker, YY1 ziet eruit als een echt veelbelovend doelwit."
 Typen instrumenten die worden gebruikt bij het meten van lichaamstemperatuur
Typen instrumenten die worden gebruikt bij het meten van lichaamstemperatuur Review benadrukt de kracht van eenvoudige fysieke modellen voor complexe eiwitmachines
Review benadrukt de kracht van eenvoudige fysieke modellen voor complexe eiwitmachines Waarom is een hoge PH slecht in je lichaam?
Waarom is een hoge PH slecht in je lichaam?  High-throughput-methode voor het identificeren van nieuwe materialen
High-throughput-methode voor het identificeren van nieuwe materialen Zoekmachine voor slim hout
Zoekmachine voor slim hout
 Antarctische zee-ijsmodellen verbeteren voor het volgende IPCC-rapport
Antarctische zee-ijsmodellen verbeteren voor het volgende IPCC-rapport Steden cooler maken is een no-brainer - dus waarom doen we er zo weinig aan?
Steden cooler maken is een no-brainer - dus waarom doen we er zo weinig aan? Wereldwijde milieuveranderingen die leiden tot kortere, jongere bomen
Wereldwijde milieuveranderingen die leiden tot kortere, jongere bomen Hoe maak je een sfinx voor school
Hoe maak je een sfinx voor school Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden
Wetenschappers onderzoeken hoe aerosoltypes wolkenvorming beïnvloeden
Hoofdlijnen
- De celstructuur van een ui
- Wat zijn de functies van zetmeel in plantencellen?
- Microevolution vs Macroevolution: Similiarities & Differences
- Het verschil tussen glycolyse en gluconeogenese
- Studie waarschuwt dat slangenschimmelziekte een wereldwijde bedreiging kan zijn
- Diffusie: wat is het? & Hoe gebeurt het?
- Waarom is chemie belangrijk voor de studie van anatomie en fysiologie?
- Welk deel van het lichaam maakt bloed?
- De evolutionaire oorsprong van de darm
- Sterke gastheren helpen parasieten zich verder te verspreiden

- Resultaten van Landmark NASA DNA Twin Study zijn binnen

- Zelfs koude harde contanten zijn niet genoeg stimulans om naar tegengestelde meningen te luisteren

- Hoe kleine robots uw gezondheid van binnenuit kunnen verbeteren
- Hoe kan iemand 11 dagen wakker blijven?

 Grondwaterpompen drogen Great Plains-stromen op, uitsterven van vissen stimuleren
Grondwaterpompen drogen Great Plains-stromen op, uitsterven van vissen stimuleren Onderzoek vindt een manier om meer gegevens in een enkele akoestische straal te verpakken voor onderwatercommunicatie
Onderzoek vindt een manier om meer gegevens in een enkele akoestische straal te verpakken voor onderwatercommunicatie Wat bestond er vóór de oerknal?
Wat bestond er vóór de oerknal?  Laatste van de Jayer-wijn gaat in de verkoop in Genève
Laatste van de Jayer-wijn gaat in de verkoop in Genève Bevat regenwater stikstof?
Bevat regenwater stikstof?  Amazon verhuist om eigen laboratorium te creëren voor COVID-19-tests voor medewerkers
Amazon verhuist om eigen laboratorium te creëren voor COVID-19-tests voor medewerkers Sabeltandtijgerskelet wordt verkocht voor meer dan $ 84, 000
Sabeltandtijgerskelet wordt verkocht voor meer dan $ 84, 000 Dinosaurussen met lange nek draaiden hun voorpoten opzij
Dinosaurussen met lange nek draaiden hun voorpoten opzij
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

