Wetenschap
Hoe verhouden een elementen Valence-elektronen zich tot hun groep in het periodiek systeem?
In 1869 publiceerde Dmitri Mendeleev een artikel met de titel 'Over de relatie tussen de eigenschappen van de elementen en hun atoomgewichten'. In dat artikel produceerde hij een geordende rangschikking van de elementen, ze opsommend in volgorde van toenemend gewicht en rangschik ze in groepen op basis van vergelijkbare chemische eigenschappen. Hoewel vele decennia over waren voordat de details van de atomaire structuur zouden worden ontdekt, organiseerde de tabel van Mendeleev al elementen in termen van valentie.
Elementen en atoomgewicht
In Mendelejev werden atomen beschouwd als ondeelbare, unieke entiteiten . Sommige waren zwaarder dan andere en het leek redelijk om de elementen te ordenen door het gewicht te verhogen. Er zijn twee problemen met deze aanpak. Ten eerste is het meten van gewicht een lastige taak, en veel van de geaccepteerde gewichten van de dag van Mendelejev waren niet correct. Ten tweede blijkt dat atoomgewicht niet echt de relevante parameter is. De periodieke tabellen van vandaag plaatsen de elementen in volgorde van hun atoomnummer, dat is het aantal protonen in de kern. In de tijd van Mendelejev waren protonen nog niet ontdekt.
Elementen en chemische eigenschappen
Mendelejev schreef dat "rangschikking volgens atoomgewicht overeenkomt met de valentie van het element en tot op zekere hoogte het verschil in chemisch gedrag ." De valentie was volgens Mendelejev een indicatie van het vermogen van een element om te combineren met andere elementen. Mendelejev combineerde de volgorde van atoomgewicht met gemeenschappelijke valenties om de elementen in een tabel te ordenen. Dat wil zeggen, hij organiseerde de elementen in groepen op basis van hun chemische eigenschappen. Omdat die eigenschappen om de zoveel tijd worden herhaald, was het resultaat een periodieke tabel waarin elke verticale kolom, een groep genoemd, elementen met vergelijkbare kenmerken bevat en elke horizontale rij, een periode genoemd, de elementen rangschikt op gewicht, van links naar rechts stijgend en van boven naar beneden.
Atoomstructuur
Ongeveer 50 jaar na het eerste periodieke systeem van Mendelejev ontdekten wetenschappers dat het atoom was gebouwd rond een kern met positief geladen protonen en neutrale neutronen - die beide relatief zwaar zijn. De positief geladen kern is omgeven door een wolk van negatief geladen elektronen. Het aantal protonen - ook wel het atoomnummer genoemd - komt meestal overeen met het aantal elektronen. Het blijkt dat het aantal elektronen dat een element heeft grotendeels de chemische eigenschappen bepaalt. Dus de juiste volgorde in het periodiek systeem wordt bepaald door het aantal elektronen, niet het gewicht zoals Mendeleev oorspronkelijk had voorgesteld.
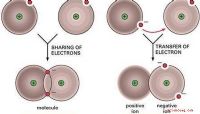
Valence Electrons
De elektronen in de wolk rond de kern van een element zijn gerangschikt in lagen, schelpen genoemd . Elke schaal heeft een specifiek aantal elektronen die hij kan vasthouden. Wanneer elke schaal is gevuld, wordt een nieuwe schaal toegevoegd totdat alle elektronen worden verantwoord. Elektronen in de buitenste schil worden valentie-elektronen genoemd, omdat hun interacties de chemische eigenschappen van een element bepalen. De kolommen die werden opgezet om elementen te groeperen door vergelijkbare chemische eigenschappen, blijken exact dezelfde kolommen te zijn die worden gedefinieerd door het aantal valentie-elektronen. Elementen in groep 1A hebben slechts één valentie-elektron, en elke kolom van groep A aan de rechterkant voegt nog een valentie-elektron toe. Organisatie wordt een beetje troebel met de elementen van Groep B, maar elk van hen is ook gegroepeerd op hun aantal valentie-elektronen.
Hoofdlijnen
- Wat zijn de subeenheden van DNA?
- Hoe werkt ruw ER met Ribosomes?
- How Do Ions Cross the Lipid Bilayer of the Cell Membrane?
- Is de Krebs-cyclus aëroob of anaëroob?
- Volledig diagram van het menselijk lichaam
- Celwand: definitie, structuur en functie (met diagram)
- Forensische wetenschapsprojecten voor middelbare scholieren
- Hoe CFU uit verdunning te berekenen
- Hoeveel Valence-elektronen heeft natrium?
 Wie vond tessellaties uit?
Wie vond tessellaties uit?  Waarom willen sommige wetenschappers buizen door de open oceaan verspreiden?
Waarom willen sommige wetenschappers buizen door de open oceaan verspreiden?  SpaceX heeft zojuist een superheld-ontwerpteam ingehuurd voor zijn ruimtepakken
SpaceX heeft zojuist een superheld-ontwerpteam ingehuurd voor zijn ruimtepakken  Het Rendlesham Forest-incident
Het Rendlesham Forest-incident  Hoe MRNA naar TRNA
Hoe MRNA naar TRNA Hoe de straal te vinden
Hoe de straal te vinden  Fysieke kenmerken van het noordoosten
Fysieke kenmerken van het noordoosten  Wat zijn alle draden op nutsstroompalen?
Wat zijn alle draden op nutsstroompalen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com