Wetenschap
Een moleculaire dans van fosfolipidesynthese
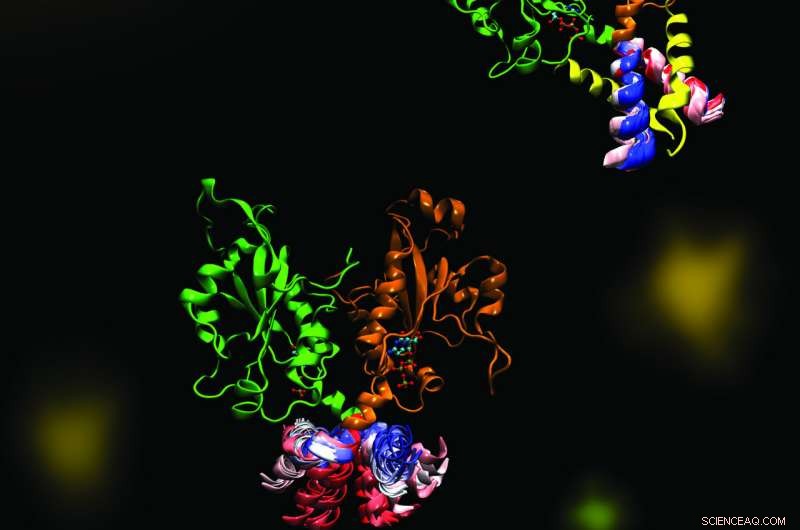
CCT is een sleutelenzym dat zorgt voor een evenwichtige samenstelling van celmembraanfosfolipiden. Afbeelding benadrukt de dynamiek van een deel van het enzym CCT dat essentieel is voor de regulering van zijn functies. De moleculaire dynamica werd onderzocht in een samenwerking tussen de Cornell- en Tieleman-labs met behulp van computationele methoden. Krediet:Mohsen Ramezanpour en Jaeyong Lee
Het meest voorkomende molecuul in celmembranen is het lipide fosfatidylcholine (PC, algemeen bekend als lecithine); overeenkomstig, de enzymen die verantwoordelijk zijn voor de synthese ervan zijn essentieel. Onderzoek gepubliceerd in het nummer van 4 mei van de Tijdschrift voor biologische chemie gebruikten computersimulaties om inzicht te krijgen in hoe een van deze enzymen de pc-productie activeert en afsluit. Deze resultaten kunnen onderzoekers helpen begrijpen waarom kleine veranderingen in dit enzym kunnen leiden tot aandoeningen zoals blindheid en dwerggroei.
Rozemarijn Cornell, een professor in moleculaire biologie en biochemie aan de Simon Fraser University in Canada, bestudeert het enzym CTP:phosphocholine cytidylyltransferase, of CCT. CCT bepaalt de snelheid van pc-productie in cellen door te binden aan celmembranen met een laag pc-gehalte. Wanneer gebonden aan membranen, het CCT-enzym verandert van vorm op een manier die het mogelijk maakt om de belangrijkste snelheidsbeperkende stap in pc-synthese uit te voeren. Wanneer de hoeveelheid PC waaruit het membraan bestaat toeneemt, de CCT valt van het membraan, en pc-productie stopt.
"Het membraan is een grote macromoleculaire reeks met veel verschillende moleculen erin, " zei Cornell. "Hoe herkent dit enzym dat 'Oh, Ik moet langzamer gaan omdat de pc-inhoud van het membraan te hoog wordt?'"
Cornell en haar projectteam - een samenwerking met Peter Tieleman en afstudeerder, Mohsen Ramezanpour aan de Universiteit van Calgary en Jaeyong Lee en Svetla Taneva, onderzoeksmedewerkers bij SFU - dachten dat het antwoord te maken moet hebben met de dynamische vormveranderingen die het enzym ondergaat wanneer het zich aan een membraan bindt. Maar deze veranderingen zijn moeilijk vast te leggen met traditionele structurele biologiemethoden zoals röntgenkristallografie, die een statische momentopname van moleculen maken. In plaats daarvan, het team gebruikte computationele simulaties van moleculaire dynamica, die informatie gebruiken over de krachten tussen elk afzonderlijk atoom in een molecuul om de banen van de bewegende delen van het enzym te berekenen.
"Hoe het eruit ziet (als je de output visualiseert) is je grote molecuul dat voor je ogen danst, Cornell zei. "We hebben de moleculaire dynamica-simulatie niet één keer opgezet, niet twee keer, maar 40 verschillende (tijden). Het kostte maanden en maanden om alleen de computationele delen te doen en nog meer maanden om de gegevens daarna te analyseren. We hebben echt veel tijd besteed toen we de gegevens eenmaal op het scherm naar deze dansende moleculen hadden gekeken."
De gesimuleerde dans van het CCT-molecuul toonde aan dat wanneer het M-domein, het deel van het enzym dat gewoonlijk aan het membraan bindt, los van een membraan, het hakt in op de actieve plaats van het enzym, voorkomen dat het zijn reactie uitvoert. Toen het vastgelopen segment uit de simulatie werd verwijderd, het team zag een dramatische buigbeweging in de aanlegplaats voor het vasthakende element, en speculeerde dat deze buiging een betere enzym-actieve plaats zou creëren voor het katalyseren van de reactie wanneer deze aan een membraan wordt bevestigd. Het team bevestigde deze mechanismen met behulp van biochemische laboratoriumexperimenten.
interessant, eerdere genetische studies hadden aangetoond dat mutaties in het gen dat codeert voor CCT verantwoordelijk zijn voor zeldzame aandoeningen zoals spondylometafysaire dysplasie met kegelstaafdystrofie, die ernstige stoornissen in de botgroei en het gezichtsvermogen veroorzaakt, maar het was niet bekend hoe deze veranderingen in het enzym tot zulke dramatische gevolgen konden leiden. Cornell hoopt dat het begrijpen van hoe het enzym werkt, onderzoekers kan helpen erachter te komen.
"Als je maar één kleine verandering in CCT hebt, hoe gaat dat hele proces van het synthetiseren van pc dan defect maken?', vraagt Cornell. 'Dat is wat we nu aan het bestuderen zijn.'
 Wetenschappers onthullen dynamische koppeling van sterke waterstofbrug
Wetenschappers onthullen dynamische koppeling van sterke waterstofbrug Elektrische pulsen gebruiken voor vaccinefficiëntie
Elektrische pulsen gebruiken voor vaccinefficiëntie Hoe u berekeningen voor microdruppels kunt uitvoeren per minuut
Hoe u berekeningen voor microdruppels kunt uitvoeren per minuut Wat zijn enkele chemische reacties die worden gebruikt bij de productie van papier?
Wat zijn enkele chemische reacties die worden gebruikt bij de productie van papier?  Waarom is regen natuurlijk zuur?
Waarom is regen natuurlijk zuur?
 Ozonherstel kan worden vertraagd door niet-gereguleerde chemicaliën
Ozonherstel kan worden vertraagd door niet-gereguleerde chemicaliën Twintig doden terwijl recordregens in Japan leiden tot massale evacuaties
Twintig doden terwijl recordregens in Japan leiden tot massale evacuaties 200 jaar geleden, mensen ontdekten Antarctica - en begonnen de dieren te slachten tot bijna uitsterven voor winst
200 jaar geleden, mensen ontdekten Antarctica - en begonnen de dieren te slachten tot bijna uitsterven voor winst Californië tot zweepslag tussen droogte, overstromingen:studie
Californië tot zweepslag tussen droogte, overstromingen:studie Plantaardige vliegtuigbrandstof kan de uitstoot met 68% verminderen
Plantaardige vliegtuigbrandstof kan de uitstoot met 68% verminderen
Hoofdlijnen
- Wat zijn de biomoleculen van ribosomen?
- Nieuwe soorten mariene spin verschijnen bij eb om wetenschappers aan Bob Marley te herinneren
- Alles in de familie:gerichte genomische vergelijkingen
- Cannabis kweken met moderne wetenschap en technologie
- Meer dan een getallenspel:nieuwe techniek meet microbiële gemeenschappen op biomassa
- Vergelijking van klonen met mitose
- Zwavelademhaling bij zoogdieren
- Waarom zijn de Neanderthalers uitgestorven?
- Wat gebeurt er met een Zygote na bevruchting?
 Welke sedimenten maken een goede watervoerende laag?
Welke sedimenten maken een goede watervoerende laag?  Verschil tussen transcriptie en DNA-replicatie
Verschil tussen transcriptie en DNA-replicatie  Onderzoekers ontwikkelen e-skin om robots en protheses tastzin te geven
Onderzoekers ontwikkelen e-skin om robots en protheses tastzin te geven Hoe het volume van vloeistof in een pijp te berekenen
Hoe het volume van vloeistof in een pijp te berekenen Een uitgebalanceerd ecosysteem gebruikt water het meest efficiënt
Een uitgebalanceerd ecosysteem gebruikt water het meest efficiënt Nieuwe plaatsing voor een van de grootste massa-extincties op aarde
Nieuwe plaatsing voor een van de grootste massa-extincties op aarde Spark joy:gebruik de op Marie Kondo geïnspireerde methode om uw smartphone op te ruimen, tablet en laptop
Spark joy:gebruik de op Marie Kondo geïnspireerde methode om uw smartphone op te ruimen, tablet en laptop Medische richtlijnen voor astronauten die in de VS worden gelanceerd
Medische richtlijnen voor astronauten die in de VS worden gelanceerd
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com