
Wetenschap
Lang gezochte structuur van telomerase effent de weg voor nieuwe geneesmiddelen voor veroudering, kanker
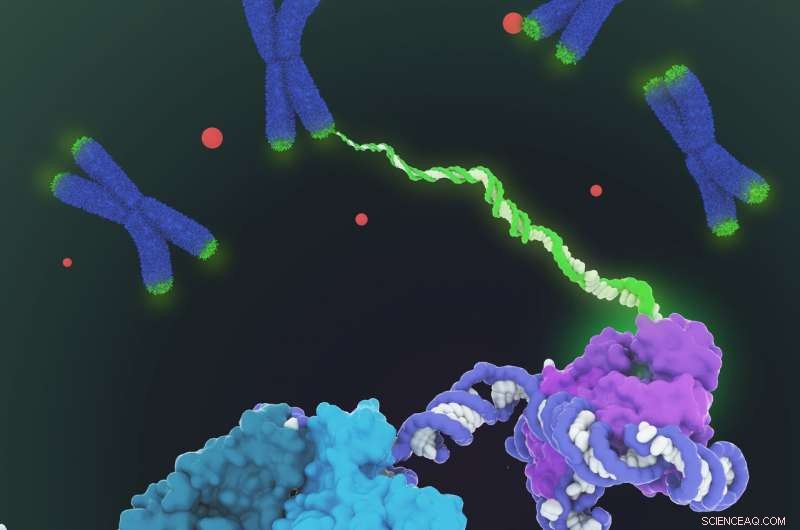
Getoond wordt het ruimtevullende model van de menselijke telomerase holoenzymstructuur bepaald door cryo-elektronenmicroscopie (cryo-EM). Telomerase katalyseert de synthese van telomeer DNA (groen) aan de uiteinden van chromosomen (blauw) om het verlies van telomeren tijdens genoomreplicatie te compenseren. De structuur bestaat uit twee lobben met verschillende functionaliteiten:de katalytische kern (paars) die verantwoordelijk is voor de DNA-synthese en een H/ACA-ribonucleoproteïnelob (cyaan, blauwgroen en lichtgroen) belangrijk voor de biogenese van telomerase en lokalisatie naar het Cajal-lichaam (rode stippen en linksonder in close-up). Aangezien telomeraseregulatie een rol speelt bij kanker en veroudering, deze eerste architecturale visualisatie van menselijke telomerase vertegenwoordigt een belangrijke doorbraak op het gebied van telomerase en op telomerase gebaseerd therapeutisch ontwerp. Krediet:Janet Iwasa
Meer dan 30 jaar geleden, toen de Universiteit van Californië, Onderzoekers van Berkeley ontdekten telomerase - een enzym dat chromosoomuiteinden verlengt en voorkomt dat ze voldoende rafelen om een cel te doden - er werd wild gespeculeerd over zijn rol bij veroudering en kanker, een full-court pers op gang brengen om medicijnen te produceren om het enzym te activeren of te blokkeren.
Hoewel geen van beide op telomerase gebaseerde anti-verouderingsmedicijnen, aangeprezen als een "fontein van de jeugd, " er zijn nog geen geneesmiddelen tegen kanker verschenen, de publicatie vandaag door wetenschappers van UC Berkeley van het eerste gedetailleerde beeld van de moleculaire structuur van menselijke telomerase zou die inspanning een vliegende start moeten geven, waardoor meer gerichte medicijnscreening en intelligent ontwerp van nieuwe medicijnen mogelijk is.
"Het heeft lang geduurd. Er was veel doorzettingsvermogen voor nodig, " zei Kathleen Collins, een professor in de moleculaire en celbiologie van UC Berkeley die 26 jaar aan het enzym heeft gewerkt.
Collins en Eva Nogales, tevens hoogleraar moleculaire en celbiologie, zijn de senior auteurs van een artikel dat de 3D-moleculaire structuur van het menselijke telomerase-enzym beschrijft, deze week gepubliceerd in het tijdschrift Natuur .
Een knelpunt is het verkrijgen van zuivere monsters van dit complexe molecuul, die is samengesteld uit een RNA-ruggengraat versierd met zes soorten eiwitten die bewegen terwijl ze DNA aan de uiteinden van chromosomen toevoegen. Labs over de hele wereld hebben gedebatteerd of het enzym afzonderlijk of als Siamese tweeling werkt, en hoe en hoeveel eiwitten de RNA-ruggengraat versieren.
Zonder consensus over deze vragen, het is moeilijk gebleken om een medicijn te ontwerpen dat zich richt op de moleculaire machine en ofwel de telomerase-activiteit vernietigt - wat een kanker zou kunnen stoppen die zijn telomerase-niveaus heeft verhoogd - of telomerase opnieuw te starten, misschien om het lichaam voor te bereiden op snelle celdeling na een beenmergtransplantatie.
De nieuw onthulde structuur mist nog steeds fijne details, maar gecombineerd met kennis van de gensequentie van humaan telomerase, het geeft voldoende informatie om na te denken over mogelijke doelwitten voor drugs, zei eerste auteur Thi Hoang Duong "Kelly" Nguyen, een postdoctoraal onderzoeker van het Miller Institute aan de UC Berkeley.
"De beste eerdere afbeeldingen van menselijke telomerase hadden een resolutie van slechts 30 ngstrom; we waren in staat om een resolutie van ongeveer 7 tot 8 Ångstrom te krijgen met behulp van cryo-elektronenmicroscopie, Kelly zei. "Toen ik op het punt kwam waarop ik alle subeenheden kon zien - we hadden in totaal 11 eiwitsubeenheden - was het een moment van, 'Wauw, Wauw, zo passen ze allemaal bij elkaar.'"
Nguyen, Collins en Nogales werken actief aan het verbeteren van de resolutie tot 3 of 4 Ångstroms - ongeveer de grootte van twee koolstofatomen - wat voldoende is voor het ontwerpen van medicijnen.
Telomerase vult de telomeren aan
Telomeren werden eind jaren zeventig voor het eerst op moleculair niveau gedetecteerd door Elizabeth Blackburn, toen aan UC Berkeley en nu emerita voorzitter van het Salk Institute for Biological Studies in La Jolla, Californië. Werken met de trilhaartjes Tetrahymena, zij en collega's toonden aan dat de uiteinden van de chromosomen worden afgedekt door zich herhalende DNA-sequenties. Gewapend met kennis van de telomeersequentie, onderzoekers toonden vervolgens aan dat telomeren in weefsels van meercellige organismen korter worden elke keer dat een cel zich deelt. De telomeren beschermen de DNA-strengen tegen rafelen en beschadiging aan de uiteinden, net als de plastic punt aan het uiteinde van een schoenveter. Het feit dat ze bij elke celdeling afvallen, zou ons beschermen tegen kanker, wanneer een cel wordt gekaapt en zich voortdurend vermenigvuldigt.
In 1985 aan de UC Berkeley, Blackburn en toenmalig afgestudeerde student Carol Greider ontdekten telomerase, een enzym dat DNA terug aan de uiteinden van chromosomen toevoegt, verlengen en verlengen van de levensduur van de cel. Blackburn, Greider en een andere collega, Jack Szosak, deelde in 2009 de Nobelprijs voor Fysiologie of Geneeskunde voor de ontdekking van telomerase.
Wetenschappers hebben sindsdien ontdekt dat, bij mensen en andere meercellige organismen, telomerase komt alleen tot expressie in het embryo, niet in de meeste volwassen cellen. Dat betekent dat de meeste cellen bij de geboorte een vooraf bepaald vermogen hebben om te groeien en te delen, waarna ze overlijden. Veel wetenschappers geloven dat uitgeputte telomeren een belangrijke oorzaak van veroudering zijn.
Collins probeert de structuur van telomerase te bepalen sinds het eerste menselijke telomerase-eiwit werd ontdekt in 1997. en zij en haar collega's hebben veel van de eiwitten in het grote enzym ontdekt en uitgebreid gekarakteriseerd, evenals de gebroken haarspeldstructuur van de RNA-ruggengraat van telomerase. Maar hoe ze allemaal in elkaar passen, was een raadsel vanwege tegenstrijdige resultaten van veel verschillende laboratoria.
Nguyen was in staat om het actieve enzym te isoleren en veel beter te zuiveren dan wie dan ook. en nam een nieuwe state-of-the-art cryo-elektronenmicroscoop om de structuur van het actieve telomerase eenduidig te bepalen. Cryo-EM is een techniek voor het bepalen van moleculaire structuren van verbindingen die niet kunnen worden gekristalliseerd en afgebeeld met röntgenstralen, en zijn ontwikkelaars wonnen de Nobelprijs voor de Scheikunde 2017.
Toen het UC Berkeley-team eenmaal de structuur had, Nguyen zei, het werd duidelijk waarom genetische mutaties in sommige van de eiwitten in telomerase interfereren met het enzym dat ziekte veroorzaakt. In 1999, Collins ontdekte de eerste bekende ziekte bij de mens veroorzaakt door een telomerasemutatie:een mutatie in een telomerase-eiwit genaamd dyskerine dat verantwoordelijk is voor een zeldzame ziekte genaamd dyskeratosis congenita. Patiënten ontwikkelen bloedarmoede en huid- en darmproblemen, en sterven meestal aan beenmergfalen.
De reden, Collins zegt, is dat er twee dyskerine-moleculen zijn gebonden aan de RNA-ruggengraat die niet alleen het netwerk van andere eiwitten moeten bereiken, maar ook elkaar moeten raken, en ziekteverwekkende mutaties voorkomen deze verbanden, het vermogen van de RNA-ruggengraat om in cellen te overleven verlammen. Sommige kinderen met dyskeratosis congenita hebben telomerase niveaus van ongeveer 25 procent van normaal en een levensduur van minder dan twee decennia. Degenen met de helft van het normale niveau van telomerase bereiken meestal een gezondheidscrisis op middelbare leeftijd.
Collins is extatisch om eindelijk een definitieve structuur voor telomerase te hebben en kijkt ernaar uit om meer te leren over het ingewikkelde assemblageproces van een van de meest complexe enzymen in het lichaam:een polymerase zo gecompliceerd als het ribosoom, die RNA leest om eiwitten te produceren.
"Ik had niet gedacht dat het zo ingewikkeld zou zijn toen ik besloot om dit molecuul te bestuderen, " zei ze. "Ik werd nieuwsgierig naar hoe telomerase werkt in 1991, toen ik net klaar was met afstuderen, en ik was op zoek naar een heel eenvoudig polymerasesysteem om nucleïnezuurinteracties te begrijpen. En ik dacht, mijn god, je kunt niet eenvoudiger zijn dan dit. Dat was super naïef."
 Bleken treft 's werelds zuidelijkste koraalrif:wetenschappers
Bleken treft 's werelds zuidelijkste koraalrif:wetenschappers De wind in Californië neemt af, maar het brandgevaar blijft groot
De wind in Californië neemt af, maar het brandgevaar blijft groot Nieuw rapport beoordeelt de gezondheid van de watervoerende laag van High Plains
Nieuw rapport beoordeelt de gezondheid van de watervoerende laag van High Plains Onderzoek naar de oorzaken van de ozonconcentraties in het natuurreservaat Valderejo
Onderzoek naar de oorzaken van de ozonconcentraties in het natuurreservaat Valderejo Overstromingen in Paraguay dwingen duizenden huizen te evacueren
Overstromingen in Paraguay dwingen duizenden huizen te evacueren
Hoofdlijnen
- Je kunt echt op je naam lijken,
- Hoe een iconische foto van een appel de inspiratie vormde voor een verbeterde celanalyse
- Kan gezichtsblindheid verklaren waarom die persoon op het werk mij nooit gedag zegt?
- Hoe helpt marihuana de gezondheid van mensen
- Gewone schimmel helpt het knokkelkoortsvirus te gedijen bij muggen
- Wetenschapsproject over waarom botten rubberachtig worden in azijn
- Clathrin-assemblage definieert het begin en de geometrie van corticale patronen
- Waarom hebben de meeste mensen 23 paar chromosomen?
- Hoe regenereert de huid?
- Nanomaterialen - korte polymeren, grote impact

- Insuline sorteren en afscheiden op vervaldatum
- Pandemie biedt unieke kans voor atmosferische chemici

- Wetenschappers leren meer over de eerste uren van de levensduur van lithium-ionbatterijen

- Revolutionaire ontdekking van geneesmiddelen met RNA in de schijnwerpers

 Zeeslakkenhuizen lossen op in steeds meer verzuurde oceanen, studie toont
Zeeslakkenhuizen lossen op in steeds meer verzuurde oceanen, studie toont Foto's die een eeuw uit elkaar zijn genomen, tonen een grimmige smelt van de Mont Blanc-gletsjer
Foto's die een eeuw uit elkaar zijn genomen, tonen een grimmige smelt van de Mont Blanc-gletsjer Startup bezorgt boodschappen in zelfrijdende auto's
Startup bezorgt boodschappen in zelfrijdende auto's Trade-offs tussen economische groei en ontbossing
Trade-offs tussen economische groei en ontbossing Een stap voorwaarts in het oplossen van het reactor-neutrinofluxprobleem
Een stap voorwaarts in het oplossen van het reactor-neutrinofluxprobleem Nieuw goedkoop thermo-elektrisch materiaal werkt bij kamertemperatuur
Nieuw goedkoop thermo-elektrisch materiaal werkt bij kamertemperatuur Seismische kartering helpt bij het opsporen van verlaten mijnen in Wyoming
Seismische kartering helpt bij het opsporen van verlaten mijnen in Wyoming Koud sinteren produceert condensatormateriaal bij record lage temperaturen
Koud sinteren produceert condensatormateriaal bij record lage temperaturen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

