Wetenschap
Nieuwe methodologie helpt bij het bestuderen van veelbelovende gerichte steigers voor medicijnafgifte
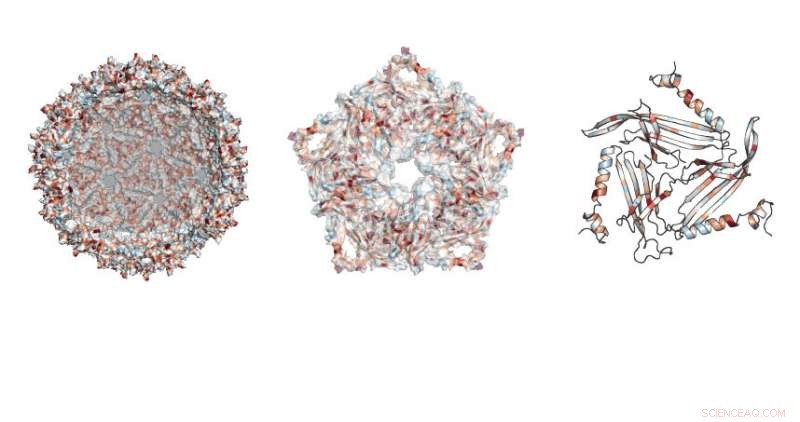
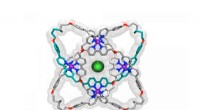
Onderzoekers bestudeerden waar mutaties waren toegestaan in de voetbalachtige structuur gemaakt door de MS2-steiger. Krediet:Northwestern University
Onderzoekers van Northwestern Engineering hebben een nieuwe manier ontwikkeld om een virusomhulsel te manipuleren dat zichzelf assembleert uit eiwitten en veelbelovend is als drager voor ziektedetectie. medicijnafgifte, en vaccinaties.
Virussen hebben omhulsels die zijn gebouwd om te overleven in barre omstandigheden, beschermen hun lading totdat ze een cel vinden om te infecteren. De schaal kan voor goed worden gebruikt, echter, omdat die stabiliteit het geschikt maakt om meer nuttige lading te beschermen, zoals medicijnen, die kunnen worden afgeleverd aan specifiek gerichte cellen.
Het onderzoek richtte zich op een eiwit dat wordt gebruikt door een bacterieel virus, de MS2-bacteriofaag. Dit eiwit kan zichzelf assembleren, het creëren van een onschadelijke steiger uit de virale schaal, zei Danielle Tullman-Ercek, universitair hoofddocent chemische en biologische technologie aan de McCormick School of Engineering.
"In de biologie, alles heeft zijn plaats. Zo is biologie geweldig, behalve dat we de regels niet kennen, "Zei Tullman-Ercek. "Onze ontdekking was de methode om die ontwerpregels te bepalen."
De studie, gedaan in samenwerking met chemieprofessor Matthew Francis en zijn collega's aan de University of California in Berkeley, duurde meer dan twee jaar. De resultaten zijn op 11 april gepubliceerd in het tijdschrift Natuurcommunicatie .
Het werk stelde de onderzoekers in staat om te onderzoeken welke specifieke eiwitmutaties de virussteiger doorbraken of de eigenschappen van de structuur veranderden. Om dat te doen, het team ontwikkelde een nieuwe techniek genaamd SyMAPS (Systematic Mutation and Assembled Particle Selection), die de gemuteerde scaffold-eiwitten scheidde die intact bleven van die die tijdens de mutatie uit elkaar braken.
In totaal, het team testte bijna 2, 600 versies van het eiwit, waaruit de gesloten schaal bestaat, voetbal-achtige steiger.
"Het MS2-scaffold-eiwit heeft 129 posities waar we een substitutie kunnen maken, het bestaande aminozuur op die positie vervangen door alle andere aminozuren, " zei Emily Hartman, een vierdejaars promovendus in de chemie aan UC Berkeley en hoofdauteur van de paper. "Door alle 20 natuurlijk voorkomende aminozuren te verwisselen, een per keer, op elke positie in het eiwit, uiteindelijk testen we 20 variabelen op 129 posities."
Het team is van mening dat inzicht in hoe mutaties de steigers veranderen, belangrijk inzicht biedt in hoe deze hergebruikte viruseiwitten in de geneeskunde kunnen worden gebruikt.
"De steiger die je wilt voor medicijnafgifte kan anders zijn dan wat je zou willen voor een vaccin, "Zei Tullman-Ercek. "Misschien willen we de eigenschappen van lading op het oppervlak veranderen om beter te kunnen richten of iets aan de binnenkant van de structuur toe te voegen, zoals het laden met een sensor of diagnostische recorder."
Bijvoorbeeld, een structuur die in een specifieke omgeving uit elkaar valt, kan helpen bij het gericht toedienen van medicijnen, zoals chemotherapie.
"Een van de dingen die we in het onderzoek deden, was zoeken naar mutanten die gevoelig zijn voor zuur, "Zei Hartman. "De bloedbaan is niet zuur, maar eenmaal in een kankercel, het is veel zuurder. Als de steiger uit elkaar valt in zure omgevingen, het zou het medicijn gemakkelijker in een kankercel vrijgeven."
Er werd een structuur gevonden die minder tolerant was voor zure omstandigheden, en het team zal op dit gebied blijven werken.
In aanvulling, de studie biedt inzicht in wat er van nature kan ontstaan bij een muterend virus, zoals griep. "Dit zou ons een idee kunnen geven van welke plaatsen in het virus een hogere mate van mutatie zouden kunnen hebben. Die informatie zou door wetenschappers kunnen worden gebruikt om nieuwe vaccins te ontwikkelen, ' zei Tullman-Ercek.
Het team en hun collega's van beide universiteiten zullen het werk gebruiken als basis voor specifieke toepassingen voor de virale scaffold, ze zei.
"Dit artikel is echt een eerste stap in een grotere reeks verhalen, Hartman zei. "Er is veel werk in deze samenwerking tussen de universiteiten. Ik ben opgewonden om te zien waar het heen gaat.
De studie bouwt voort op het eerdere werk van Tullman-Ercek, die ontdekte dat een enkele aminozuurmutatie in dezelfde MS2-bacteriofaagsteiger de grootte drastisch veranderde.
Tullman-Ercek is een faculteitslid van het Northwestern's Centre for Synthetic Biology. Het twee jaar oude centrum brengt wetenschappers uit engineering, medicijn, natuurkunde, en informatica die geïnteresseerd zijn in het manipuleren van biologie om de samenleving te helpen. Veel van de synthetische biologie is gericht op het veranderen van een cel door het veranderen van het DNA, het creëren van nieuwe gespecialiseerde producten.
 Omzetting van hernieuwbare grondstoffen op platina vertoont onverwacht gedrag
Omzetting van hernieuwbare grondstoffen op platina vertoont onverwacht gedrag De genen vinden om een betere kankerbehandeling op te bouwen
De genen vinden om een betere kankerbehandeling op te bouwen Hoe de molaire hitte van neutralisatie te berekenen
Hoe de molaire hitte van neutralisatie te berekenen De effecten van zuur op verschillende soorten metaal
De effecten van zuur op verschillende soorten metaal  Onderzoekers ontwerpen een op nanotechnologie gebaseerd systeem dat methaan kan transporteren met lagere druk en lagere kosten
Onderzoekers ontwerpen een op nanotechnologie gebaseerd systeem dat methaan kan transporteren met lagere druk en lagere kosten
 Dam in Libanon gepland bovenop breuklijn wekt angst op
Dam in Libanon gepland bovenop breuklijn wekt angst op Staghorn koraalrestauratieprojecten zijn veelbelovend in Florida Keys
Staghorn koraalrestauratieprojecten zijn veelbelovend in Florida Keys Wetenschappers beweren dat de huidige modellen voor klimaatverandering het probleem onderschatten
Wetenschappers beweren dat de huidige modellen voor klimaatverandering het probleem onderschatten Hittegolf veroorzaakt enorme smelting van Groenlandse ijskap
Hittegolf veroorzaakt enorme smelting van Groenlandse ijskap Microbiële ecologie levert nieuwe inzichten op voor toekomstig behoud van scheepswrakken
Microbiële ecologie levert nieuwe inzichten op voor toekomstig behoud van scheepswrakken
Hoofdlijnen
- Wat is een bijtmiddel in de microbiologie?
- De 3 soorten bacteriën
- Onderzoekers onthullen het mechanisme waarmee cellulaire kernen hun positie in spiercellen bereiken
- Gezocht:vrijwillige schutters om kudde bizons in Grand Canyon uit te dunnen (update)
- Als het gaat om de dreiging van uitsterven, grootte doet er toe
- mRNA: definitie, functie en structuur
- Kun je iemand echt doodsbang maken?
- Saoedi-Arabische rotskunst toont riemen op prehistorische honden
- Wat doen basale lichamen die Cilia en Flagella vormen?
 Onderzoek voorspelt dat extreme branden steeds meer deel zullen uitmaken van ons wereldwijde landschap
Onderzoek voorspelt dat extreme branden steeds meer deel zullen uitmaken van ons wereldwijde landschap MG converteren naar MEQ
MG converteren naar MEQ Massieve sterren in het vroege heelal waren mogelijk de voorouders van superzware zwarte gaten
Massieve sterren in het vroege heelal waren mogelijk de voorouders van superzware zwarte gaten Harvey-monsters opgezadeld met antibioticaresistente genen
Harvey-monsters opgezadeld met antibioticaresistente genen Te weinig eiwitten zorgen ervoor dat nanodeeltjes gaan klonteren
Te weinig eiwitten zorgen ervoor dat nanodeeltjes gaan klonteren Berekening van de ruwe geboortecijfer
Berekening van de ruwe geboortecijfer Arbeidsongeschiktheidskloof in bestemmingen na 16 jaar en werkgelegenheidsresultaten onthuld door nieuwe analyse
Arbeidsongeschiktheidskloof in bestemmingen na 16 jaar en werkgelegenheidsresultaten onthuld door nieuwe analyse Afnemende babyzangvogels hebben bossen nodig om droogte te overleven
Afnemende babyzangvogels hebben bossen nodig om droogte te overleven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French | Italian |

-
Wetenschap © https://nl.scienceaq.com