Wetenschap
Rosetta Stone-eiwit biedt nieuw mechanisme van allotery
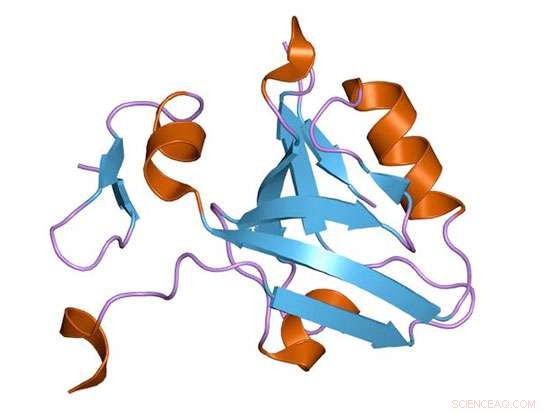
Een eiwitcartoon van een PDZ-domein van het synaptische eiwit PSD-95. Krediet:Wikimedia Commons
Voor jaren, een onopgelost probleem zeurde aan de Universiteit van Alabama in Birmingham-onderzoeker Chad Petit, doctoraat Het betrof een belangrijk biologisch fenomeen genaamd allosterie, een fundamentele methode van enzymregulatie die cruciaal is in levende cellen.
in allosterie, een ligand bindt aan een deel van het enzym, en die binding schakelt de actieve plaats van het enzym in of uit. Omdat de ligandbindingsplaats en de actieve plaats zich op verschillende delen van het enzym bevinden, er moet een biofysisch mechanisme zijn dat de twee veranderingen verbindt.
De eerste waarneming van wat later bekend zou worden als allosterie betrof hemoglobine, het eiwit dat zuurstof in het bloed vervoert. Christian Bohr, meer dan een eeuw geleden, ontdekte dat de aanwezigheid van koolstofdioxide de bindingsaffiniteit van hemoglobine voor zuurstof veranderde.
klein, nu een UAB-assistent-professor biochemie en moleculaire genetica, bij UNC-Chapel Hill had gewerkt aan een eiwitdomein van een groter eiwit dat belangrijk is voor de zenuwsynapsfunctie, samen met de toen afgestudeerde student Anthony "Tony" Law, MD, doctoraat Hun interesse was om te begrijpen hoe energie door een eiwit kon worden gepropageerd als er geen waarneembare verandering in structuur was.
In een baanbrekend 2009 PNAS papier, Petit ontdekte dat het verwijderen van een klein deel van het eiwitdomein - een alfa-spiraalvormige reeks aminozuren - een 25-voudige afname in binding veroorzaakte. Deze deletie was bedoeld om fosforylering van het PDZ3-domein na te bootsen. Het mechanisme dat werd vastgesteld om deze afname aan te sturen, bleek globale veranderingen in de bewegingen van zijketens te zijn zonder enige duidelijke verandering in de structuur van het PDZ3-eiwitdomein. Het was een van de eerste duidelijke gevallen van wat 'dynamische allosterie' zou worden genoemd.
Maar er was één paradox, een onbeantwoorde vraag die aan Petit knaagde, zelfs nadat hij was overgestapt op het bestuderen van een influenza-eiwit aan de UAB. Dat alfa-helix-deletie-eiwit was 10 procent kleiner dan het natieve PDZ3, dus het had sneller moeten tuimelen dan het natieve eiwit. Maar biofysische experimenten toonden aan dat het een bijna identieke tuimelsnelheid had in vergelijking met native PDZ3.
Door de jaren heen, Klein en recht, die nu een chirurg is in de otolaryngologie aan de University of Washington School of Medicine, keerde steeds terug naar deze puzzel. Uiteindelijk kwamen ze op een ketters idee:de onverwachte tuimelsnelheid moet te wijten zijn aan een groter volume van het kleinere eiwit.
"Dus, we begonnen experimenten te plannen, Petit zei. "We begonnen met één observatie, we hebben een hypothese gemaakt, en daarna hebben we jaren besteed aan het testen van die hypothese."
Elke hoek die we onderzochten ondersteunde die hypothese, ' zei Petit. 'Dit was pure wetenschap - het is de zuiverste wetenschap die ik ooit heb gedaan.'
Met behulp van een grabbelton met biofysische experimenten met logge namen als HSQC-spectra, NOESY-analyse, differentiële scanning calorimetrie isothermen, kleine-hoek röntgenverstrooiing en spin-relaxatie, evenals experimenten in aanwezigheid van oplosmiddelen die werken als stabiliserende of destabiliserende osmolyten, klein, Law en hun onderzoekscollega's kwamen tot de volgende conclusie:het alfa-helix-deletie-eiwit was inderdaad in omvang toegenomen, en het was in feite groter in volume dan het natieve PDZ3-eiwit. Verder, deze ontspannen grootte trad op zonder enige waarneembare verandering in eiwitstructuur.
Het deletie-eiwit met een groter volume vertoonde alle normale kenmerken van het dichter opeengepakte natieve eiwit, en het zou experimenteel kunnen worden gecomprimeerd door temperatuurveranderingen of stabiliserende osmolyten.
als kleintje, Law en hun collega's onderzochten de literatuur, ze zagen dat mensen al 35 jaar geleden aanwijzingen hadden gezien van zo'n nieuw allosterisch mechanisme, en verschillende artikelen gaven een algemeen gevoel dat het kan voorkomen in andere eiwitten of enzymen.
Deze bevinding - althans op het gebied van biofysica en scheikunde - was een behoorlijk grote plons.
Hun papier werd aanvaard door de Tijdschrift van de American Chemical Society , met een impactfactor van 13, en ze werden gevraagd om de omslagillustratie te maken. Het papier was te zien in de JAC Spotlight van het tijdschrift, en het werd ook geselecteerd door de faculteit van 1000, een groep van 8, 000 senior wetenschappers die de belangrijkste onderzoeksartikelen in biologie en geneeskunde aanbevelen.
Zoals Petit en collega's in hun krant schreven, "De onverwachte observatie dat functie kan worden afgeleid uit uitgebreide, eiwittoestanden met een lage dichtheid hebben brede implicaties voor ons begrip van allosterie en suggereert dat het algemene concept van de natieve toestand wordt uitgebreid om meer variabele fysieke afmetingen mogelijk te maken met een lossere verpakking."
"Het is het beste papier dat ik heb gemaakt, zei Petit. "Om welke reden dan ook, dit deletie-eiwit stelde ons in staat om dit mechanisme te bestuderen. Tony noemt het onze Rosetta Stone."
 Vacaturedynamiek op met CO bedekte Pt(111)-elektroden
Vacaturedynamiek op met CO bedekte Pt(111)-elektroden Rood, wit maar zelden blauw - de wetenschap van vuurwerkkleuren, uitgelegd
Rood, wit maar zelden blauw - de wetenschap van vuurwerkkleuren, uitgelegd Hoe het percentage ionisatie te berekenen
Hoe het percentage ionisatie te berekenen Unieke structurele fluctuaties aan het ijsoppervlak bevorderen auto-ionisatie van watermoleculen
Unieke structurele fluctuaties aan het ijsoppervlak bevorderen auto-ionisatie van watermoleculen Onderzoek toont aan dat keramiek kan vervormen als metalen als het onder een elektrisch veld wordt gesinterd
Onderzoek toont aan dat keramiek kan vervormen als metalen als het onder een elektrisch veld wordt gesinterd
 Weer tot klimaat:meer onderzoek nodig om invloeden van zeelucht te begrijpen
Weer tot klimaat:meer onderzoek nodig om invloeden van zeelucht te begrijpen NASA's IMERG berekende regenval van tropische cycloon 03S
NASA's IMERG berekende regenval van tropische cycloon 03S Nieuw, groenere vooruitzichten voor afvalgassen van staal
Nieuw, groenere vooruitzichten voor afvalgassen van staal Afbeelding:verwoestende Kincaid-brand in Californië blijft zich verspreiden
Afbeelding:verwoestende Kincaid-brand in Californië blijft zich verspreiden Wijzigingen in het watersysteem volgen door te luisteren naar communicatie van microalgen
Wijzigingen in het watersysteem volgen door te luisteren naar communicatie van microalgen
Hoofdlijnen
- Lijst van aseksueel reproducerende organismen
- Wat zijn genetisch gemodificeerde organismen (GGO's)? Zijn ze veilig?
- Welke oorzaken smeren bij elektroforese?
- Wat gebeurt er met de nucleaire envelop tijdens cytokinese?
Cytokinese is de verdeling van één cel in twee en is de laatste stap na de mitotische celcyclus in vier stadia. Tijdens cytokinese blijft de nucleaire envelop, of kernmembraan, die het gen
- Een grote stap in de richting van het verminderen van streptokokken bij op de boerderij gekweekte tilapia
- Bacteriën krijgen resistentie van concurrenten
- Droogte geen dingo's achter het uitsterven van tijgers op het vasteland van Australië:studie
- Bosplantages zijn een krachtige melange voor de koffieproductie
- Onderzoekers observeren enzymen die cellulose afbreken om de productie van biobrandstoffen te ondersteunen
 Laat u niet misleiden door valse afbeeldingen en video's online
Laat u niet misleiden door valse afbeeldingen en video's online Wetenschappers ontdekken overvloed aan plastic dat is opgebouwd in zee-ijs dat is verzameld in de noordwestelijke doorgang van het noordpoolgebied
Wetenschappers ontdekken overvloed aan plastic dat is opgebouwd in zee-ijs dat is verzameld in de noordwestelijke doorgang van het noordpoolgebied De mensheid terugbrengen naar de maan
De mensheid terugbrengen naar de maan Vuilnisplukkende meeuwen poepen tonnen voedingsstoffen
Vuilnisplukkende meeuwen poepen tonnen voedingsstoffen Californië zoekt naar manieren om invloed op het milieu te behouden
Californië zoekt naar manieren om invloed op het milieu te behouden Groot-Brittannië begint met het opzetten van de eerste internetwaakhond
Groot-Brittannië begint met het opzetten van de eerste internetwaakhond Antarctica:scheuren in het ijs
Antarctica:scheuren in het ijs Gegevens over zwaartekrachtsgolven suggereren dat zwarte gaten van Goudlokje zeldzaam zijn
Gegevens over zwaartekrachtsgolven suggereren dat zwarte gaten van Goudlokje zeldzaam zijn
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com