
Wetenschap
In vivo productie van CAR-T-cellen met behulp van virus-mimetische fusogene nanoblaasjes
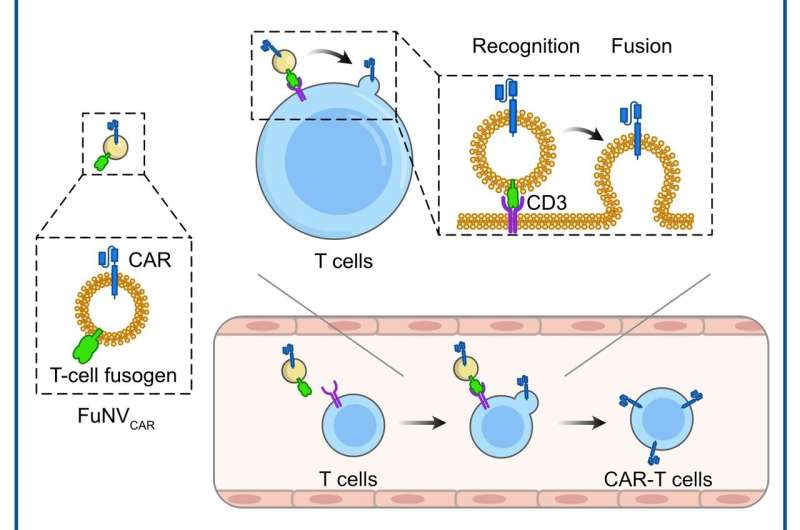
Chimere antigeenreceptoren (CAR's) zijn gesynthetiseerde membraaneiwitten die lymfocyten in staat stellen de specifieke antigenen van doelcellen te herkennen en erop te reageren. Ondanks de indrukwekkende werkzaamheid van CAR-T-celtherapie bij de behandeling van B-cellymfoom of leukemie, heeft het dure en complexe productieproces de wijdverbreide klinische toepassing ervan belemmerd.
Eerder onderzoek heeft het gebruik van nanodeeltjes onderzocht voor het afleveren van nucleïnezuren om circulerende T-cellen in vivo te programmeren, waardoor de generatie van CAR-T-cellen wordt gestroomlijnd en de noodzaak voor het isoleren van T-cellen van patiënten wordt vermeden. Ondertussen zou het rechtstreeks inbrengen van het CAR-eiwit in het T-celmembraan een eenvoudige methode kunnen zijn, waarbij complicaties zoals het cytokine-release-syndroom (CRS) en het tumorgene risico dat gepaard gaat met willekeurige insertie van virale genen in het genoom worden omzeild.
Onder leiding van prof. Jun Wang en prof. Cong-Fei Xu van de School of Biomedical Sciences and Engineering aan de South China University of Technology hebben onderzoekers een veelbelovende strategie ontwikkeld die de directe fusie van CAR-moleculen omvat, vooraf tot expressie gebracht op fusogene nanoblaasjes (FuNVs), aan T-cellen, waardoor CAR-T-cellen in vivo worden geconstrueerd.
Ze ontwikkelden het T-cel-fusogen door een variabel anti-CD3-fragment met enkele keten toe te voegen aan het reovirus of het mazelenvirus-fusogen. Ze toonden aan dat FuNV's afgeleid van cellen die T-cel-fusogen tot expressie brengen een aanzienlijke hoeveelheid T-cel-fusogen bevatten, die op efficiënte wijze de fusie tussen NV's en T-cellen induceerde, zowel in vitro als in vivo.
Vervolgens werden, rekening houdend met het klinische succes van anti-CD19 (αCD19) CAR-T-cellen, de gemanipuleerde cellen die T-cel-fusogen en αCD19 CAR-eiwit tot expressie brengen geconstrueerd om αCD19 CAR-dragende FuNV's (FuNVCAR) te produceren. ). De productie van CAR-T-cellen werd met succes bereikt door CAR-eiwit op T-cellen af te leveren via FuNVCAR in vitro en in vivo. Ondertussen intraveneuze injectie van FuNVCAR remde de groei van B-cellymfoom effectief.
Om de potentiële toxiciteit van FuNVCAR verder te onderzoeken Bloedtellingen en biochemische serumanalyses werden uitgevoerd na 2 dagen en 14 dagen, wat de vergelijkbaarheid met de controlegroep aantoonde. Gedurende de behandeling met FuNVCAR werden bij muizen geen significante veranderingen in lichaamsgewicht waargenomen.
Bovendien is er, in tegenstelling tot de traditionele CAR-T-celbehandeling, behandeling met FuNVCAR induceerde geen verhoogde afgifte van inflammatoire cytokines. Dit waargenomen verschil kan worden toegeschreven aan voorbijgaande CAR-T-cellen geproduceerd door FuNVCAR , dat een beperkte en tijdelijke activering ondergaat, waardoor de aanhoudende afgifte van inflammatoire cytokines wordt verminderd.
Samenvattend introduceert deze studie een nieuwe aanpak voor in vivo CAR-T-celproductie via FuNV-gemedieerde CAR-eiwitafgifte. Het is echter essentieel op te merken dat deze strategie mogelijk niet geschikt is voor patiënten met een verminderde T-celfunctie.
De bevindingen zijn gepubliceerd in het tijdschrift Science Bulletin .