
Wetenschap
Het geheim van celgroei zit misschien in jojo- en versnellingsneigingen
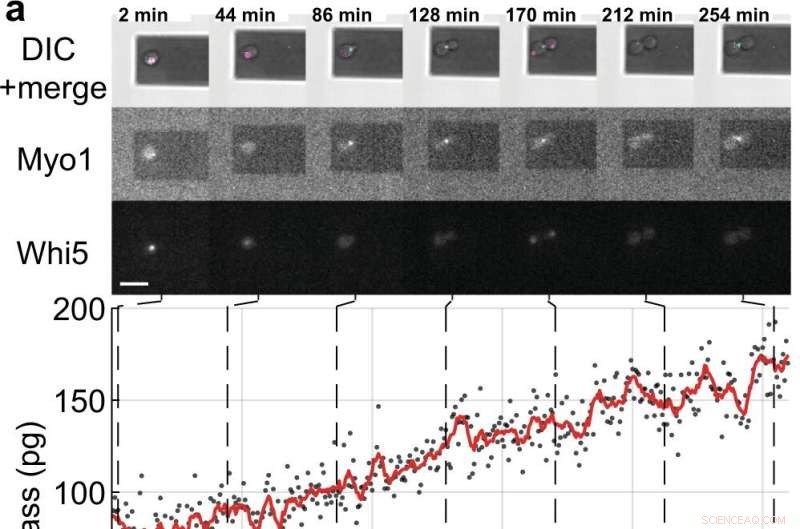
Massa- en celcyclusmetingen van enkele S. cerevisiae-cellen die ontluikende dochtercellen. a, b Enkele gistcellen die de fluorescent gelabelde celcyclusmarkereiwitten tot expressie brengen (Myo1-mKate2 (3×) en Whi5-mKOκ (1×)), werden afgebeeld met behulp van differentieel interferentiecontrast (DIC) en fluorescentiemicroscopie elke 2 min (bovenste panelen ). Een fase- en amplitudecurve van de microcantilever werden opgenomen over intervallen ≈50 s om de celmassa te meten met behulp van de sweep-modus (aanvullende film 4). Tussen opeenvolgende massametingen werden de infrarood- en blauwe lasers van de picobalans gedurende ≈ 20 s uitgeschakeld om het bleken van de fluoroforen te verminderen en om mogelijke verstoring van de gistgroei te verminderen. Celmassawaarden zoals afgeleid van sets van enkele amplitudecurven worden weergegeven als grijze stippen. Gemiddelde onbewerkte gegevens (350 s bewegend venster, rode lijn) tonen de trend. Cyaan balken op de tijdas duiden de S/G2/M-fase van de gistcelcyclus aan, en magenta balken geven de G1-fase aan. De ster (*) in b geeft het (gedeeltelijke) loslaten van de dochtercel na cytokinese aan, waardoor de totale massa daalt. Schaalbalken (wit), 10 m. c Groeicurven van (n =19) enkele gistcellen die de S/G2/M-fase doorlopen (knopgroei), zoals gemeten door de picobalans met behulp van de sweep-modus in (n =19) onafhankelijke experimenten. De totale groeisnelheid tussen begin- en eindmassa ligt tussen 0,1 en 2,0 pg min –1 , met een gemiddelde van 0,7 ± 0,5 pg min –1 (gemiddelde ± SD). De duur van de S/G2/M-fase varieert van 57 tot 184 min, met een gemiddelde van 96 ± 35 min. Krediet:Natuurcommunicatie (2022). DOI:10.1038/s41467-022-30781-y
Cellen, de meest elementaire levenseenheden die alle levende organismen vormen, hebben lang hun geheimen bewaard, maar nu heeft een internationaal team van de Universiteit van Sydney, ETH Zürich en de Universiteit van Basel enkele van hun geheimen blootgelegd door de ontwikkeling van een wereld -eerste techniek.
Wetenschappers weten dat cellen groeien, maar algemeen werd aangenomen dat ze lineair of exponentieel groeien voordat ze zich delen.
Nu, in een paper gepubliceerd in Nature Communications mede geleid door de natuurkundige Dr. David Martinez-Martin van de Universiteit van Sydney, met behulp van een nanotechnologietechniek genaamd "inertiële picobalans", hebben wetenschappers vastgesteld dat gist op het niveau van een enkele cel groeit in opeenvolgende intervallen of segmenten van lineaire groei (constante groeisnelheid) . Bij elk interval schakelen gistcellen over op snellere of langzamere groei - een "versnellingsachtige" neiging.
Het onderzoek werd uitgevoerd met saccharomyces cerevisiae, een eencellig gistorganisme dat essentieel is voor de productie van brood, bier, wijn en farmaceutica. De eiwitcoderende genen van veel soorten gist spiegelgenen in dierlijke cellen, waardoor het gedrag ervan de sleutel is tot het begrijpen van menselijke ziekten.
Met name het gedrag dat in gist wordt aangetroffen, verschilt aanzienlijk van dat van dierlijke cellen (inclusief mensen). It was not until 2017 that Dr. Martinez-Martin and colleagues, also using picobalance, first observed that the mass of living mammalian cells fluctuate intrinsically—they "yo-yo" in size.
"We have uncovered processes that challenge models in biology that have been central for decades," said Dr. Martinez-Martin. "The behaviors we have identified in cells from fungus and animal kingdoms provide strong evidence that cells have different strategies to regulate their mass and size, paving the way to better understand how they can accurately form and reform complex structures such as the eyes, brain and fingers in our bodies."
A recent mathematical model published in Journal of Biological Research—Thessaloniki by Dr. Martinez-Martin also offers fresh insight into the meaning of this once-secretive cellular flux.
"Another of our recent studies has found that while cell mass fluctuations have been detected in single mammalian cells, they can be perfectly viable in organisms comprised of many mammalian cells, including humans. Our modeling suggests that the body's cells don't all swell and decrease at the same time—instead they give and take from each other, maintaining an adequate distribution of the body's mass and volume.
"Mass fluctuations may be used by cells to regulate cellular functions such as metabolism, gene expression, proliferation and cell death, by means of altering the concentration and crowdedness of chemical cellular components."
The model also suggests that mass fluctuations allow cells to communicate, both by acting as biomechanical signals through volume fluctuations, and through the exchange of water and molecules.
"I believe this could be a fundamental mechanism which may help cells locate and communicate their position within an organism," Dr. Martinez-Martin said. "Therefore, it could be incredibly important, because it could allow cells to identify and serve their distinct role and purpose in the body."
"Researchers believe that a better understanding of how cells change their mass and size over time, as well as dysregulation of this process (when cells change their size atypically), could be the key to developing the next generation of diagnostics and treatments for a range of diseases, such as cancer, diabetes and cardiovascular disease."
About inertial picobalance:The technique used in the discovery
Dr. Martinez-Martin, who has been recently distinguished by the World Intellectual Property Organization as a young change maker, is the principal inventor of inertial picobalance, a new technology that measures the mass of single or multiple living cells in real-time, enhancing the understanding of cell physiology. The technology is currently being commercialized by the Swiss nanotech company, Nanosurf AG.
In a Nature paper published in 2017, using inertial picoblance, Dr. Martinez-Martin and his colleagues discovered that the mass of living mammalian cells fluctuates intrinsically by one to four percent over seconds, largely due to water entering and exiting cells.
Using this technique, they were also able to observe cells infected with the vaccinia virus (a virus from the poxvirus family). The infected cells showed different mass behavior over time than non-infected cells, potentially enabling a new way of detecting viral infections. + Verder verkennen
Getting bacteria and yeast to talk to each other, thanks to a 'nanotranslator'
 Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank
Coumarineverbindingen uit eikenhouten vaten kunnen bijdragen aan de bittere smaak van wijn en sterke drank Nieuw algoritme zorgt voor snellere, diervrije chemische toxiciteitstesten
Nieuw algoritme zorgt voor snellere, diervrije chemische toxiciteitstesten Ontwerpen van synthetische materialen op natuurlijke basis
Ontwerpen van synthetische materialen op natuurlijke basis Nieuw materiaal detecteert niveaus van UV-straling en bewaakt de stralingsdosis
Nieuw materiaal detecteert niveaus van UV-straling en bewaakt de stralingsdosis Onderzoekers ontwikkelen nieuwe behandeling voor botinfectie met koperrijk glasimplantaat
Onderzoekers ontwikkelen nieuwe behandeling voor botinfectie met koperrijk glasimplantaat
 Suomi NPP-satelliet ziet tropische storm Boris vorm
Suomi NPP-satelliet ziet tropische storm Boris vorm Orkaan Douglas wint aan kracht; omzeilt de staat Hawaï
Orkaan Douglas wint aan kracht; omzeilt de staat Hawaï Boren naar olie in de Grote Australische Bocht zou rampzalig zijn voor het zeeleven en de lokale gemeenschap
Boren naar olie in de Grote Australische Bocht zou rampzalig zijn voor het zeeleven en de lokale gemeenschap Kinderen in Zuid-Azië het hardst getroffen door luchtvervuiling zegt studie
Kinderen in Zuid-Azië het hardst getroffen door luchtvervuiling zegt studie Zeta doordrenkt de Caribische kust van Mexico, gaat naar de VS
Zeta doordrenkt de Caribische kust van Mexico, gaat naar de VS
Hoofdlijnen
- Habitatverlies is de grootste bedreiging voor Australische soorten
- Onderzoek verduidelijkt de functie van de nucleaire hormoonreceptor in planten
- Wat zijn de vijf klassen van immunoglobulinen?
- Zeewier bevat veel vitamines en mineralen, maar dat is niet de enige reden waarom westerlingen er meer van zouden moeten eten
- Ezels hebben meer bescherming nodig tegen de winter dan paarden
- Kunstmatige intelligentie kan worden gebruikt om bossen in Maines beter te monitoren, vondsten te bestuderen
- Gekooide blauwe mosselen als milieudetectives
- Belangrijke feiten over het koninkrijk Monera
- Hoeveel (DNA) schade kan een kankercel verdragen?
- Borofeen op zilver groeit vrijelijk uit tot een atomaire huid

- Organische halfgeleidertransistor gemaakt van een enkel nanodeeltje bereikt de hoogste mobiliteit tot nu toe

- Studie verbetert de uitlijning van enkelwandige koolstofnanobuizen langs de gemeenschappelijke as aanzienlijk

- Topologische isolatoren hebben verliesvrije geleiding aan de randen

- Kunstmatige organellen op basis van hybride eiwitnanodeeltjes
 Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën
Onderzoekers passen E. coli aan om planten om te zetten in hernieuwbare chemicaliën Een school die diversiteit waardeert, kan gezondheidsvoordelen opleveren voor studenten van kleur
Een school die diversiteit waardeert, kan gezondheidsvoordelen opleveren voor studenten van kleur Nieuwe tool stelt wetenschappers in staat om ongrijpbare eiwitten in actie te vangen
Nieuwe tool stelt wetenschappers in staat om ongrijpbare eiwitten in actie te vangen Verwoesting terwijl orkaan Irma het Caribisch gebied teistert
Verwoesting terwijl orkaan Irma het Caribisch gebied teistert Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen
Nieuwe biosyntheseroute die uniek is voor pathogene micro-organismen Slim creëren, veerkrachtige steden voor een duurzame toekomst
Slim creëren, veerkrachtige steden voor een duurzame toekomst Dissipatieve koppeling produceren in hybride kwantumsystemen
Dissipatieve koppeling produceren in hybride kwantumsystemen Druppels beklimmen kan leiden tot efficiëntere waterwinning
Druppels beklimmen kan leiden tot efficiëntere waterwinning
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

