
Wetenschap
Therapie met kleine moleculen:dromen over big data voor kleine technologieën
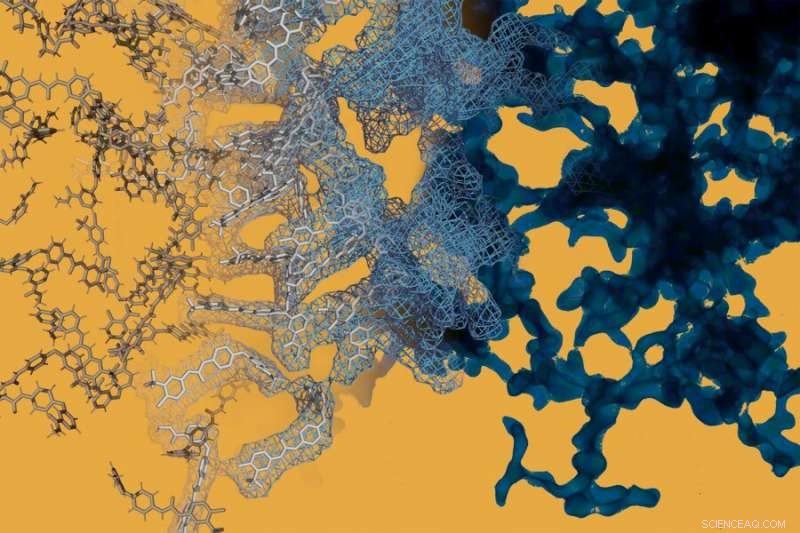
Een moleculaire dynamica-simulatie (links) wordt afgewisseld met een elektronenmicroscopiebeeld (rechts) van het kankermedicijn sorafenib. Sorafenib, net als veel andere kleine molecule medicijnen, kan spontaan ingewikkelde structuren op nanoschaal vormen die het gedrag van het medicijn veranderen. Krediet:Daniel Reker
Therapieën met kleine moleculen behandelen een breed scala aan ziekten, maar hun effectiviteit wordt vaak verminderd vanwege hun farmacokinetiek - wat het lichaam met een medicijn doet. Na toediening, het lichaam bepaalt hoeveel van het medicijn wordt geabsorbeerd, welke organen het medicijn binnenkomt, en hoe snel het lichaam het medicijn metaboliseert en weer uitscheidt.
nanodeeltjes, meestal gemaakt van lipiden, polymeren, of allebei, kan de farmacokinetiek verbeteren, maar ze kunnen ingewikkeld zijn om te produceren en bevatten vaak heel weinig van het medicijn.
Van sommige combinaties van kankermedicijnen met kleine moleculen en twee kleurstoffen met kleine moleculen is aangetoond dat ze zichzelf assembleren tot nanodeeltjes met een extreem hoge lading medicijnen, maar het is moeilijk te voorspellen welke partners met kleine moleculen nanodeeltjes zullen vormen tussen de miljoenen mogelijke paren.
MIT-onderzoekers hebben een screeningplatform ontwikkeld dat machine learning combineert met high-throughput-experimenten om zelfassemblerende nanodeeltjes snel te identificeren. In een studie gepubliceerd in Natuur Nanotechnologie , onderzoekers screenden 2,1 miljoen combinaties van medicijnen met kleine moleculen en "inactieve" medicijningrediënten, het identificeren van 100 nieuwe nanodeeltjes met mogelijke toepassingen, waaronder de behandeling van kanker, astma, malaria, en virale en schimmelinfecties.
"We hebben eerder enkele van de negatieve en positieve effecten beschreven die inactieve ingrediënten op medicijnen kunnen hebben, en hier, door een gecoördineerde samenwerking in onze laboratoria en kernfaciliteiten, een aanpak beschrijven die zich richt op de mogelijke positieve effecten die deze kunnen hebben op nanoformulering, " zegt Giovanni Traverso, de Karl Van Tassel (1925) Professor Loopbaanontwikkeling Werktuigbouwkunde, en senior corresponderende auteur van de studie.
Hun bevindingen wijzen op een strategie die zowel de complexiteit van het produceren van nanodeeltjes als de moeilijkheid om grote hoeveelheden medicijnen erop te laden oplost.
"Er zijn zoveel medicijnen die hun volledige potentieel niet waarmaken vanwege onvoldoende targeting, lage biologische beschikbaarheid, of snel medicijnmetabolisme, " zegt Daniël Reker, hoofdauteur van de studie en voormalig postdoc in het laboratorium van Robert Langer. "Door te werken op het snijvlak van data science, machinaal leren, en medicijnafgifte, onze hoop is om onze toolset snel uit te breiden om ervoor te zorgen dat een medicijn op de plaats komt waar het moet zijn en een mens daadwerkelijk kan behandelen en helpen."
Langer, de David H. Koch Institute Professor aan het MIT en een lid van het Koch Institute for Integrative Cancer Research, is ook een senior auteur van het papier.
Een kankertherapie ontmoet zijn match
Om een machine learning-algoritme te ontwikkelen dat in staat is om zelfassemblerende nanodeeltjes te identificeren, onderzoekers moesten eerst een dataset bouwen waarop het algoritme kon trainen. Ze selecteerden 16 zelfaggregerende geneesmiddelen met kleine moleculen met een verscheidenheid aan chemische structuren en therapeutische toepassingen en een gevarieerde set van 90 algemeen verkrijgbare verbindingen, inclusief ingrediënten die al aan medicijnen zijn toegevoegd om ze beter te laten smaken, duren langer, of maak ze stabieler. Omdat zowel de medicijnen als de inactieve ingrediënten al door de FDA zijn goedgekeurd, de resulterende nanodeeltjes zijn waarschijnlijk veiliger en gaan sneller door het FDA-goedkeuringsproces.
Het team testte vervolgens elke combinatie van een medicijn met een klein molecuul en een inactief ingrediënt, mogelijk gemaakt door het Swanson Biotechnology Center, een reeks kernfaciliteiten die geavanceerde technische diensten leveren binnen het Koch Institute. Na het mengen van paren en het laden van 384 monsters tegelijk op nanowellplaten met behulp van robotica in de High Throughput Sciences-kern, onderzoekers liepen over de platen, vaak met snel afbrekende monsters, naast de Peterson (1957) Nanotechnology Materials Core Facility-kern om de grootte van deeltjes te meten met dynamische lichtverstrooiing met hoge doorvoer.
Nu getraind op 1, 440 datapunten (waarvan 94 nanodeeltjes al zijn geïdentificeerd), het machine learning-platform zou kunnen worden ingeschakeld op een veel grotere bibliotheek met verbindingen. Screening van 788 geneesmiddelen met kleine moleculen tegen meer dan 2, 600 inactieve medicijningrediënten, het platform geïdentificeerd 38, 464 potentiële zelfassemblerende nanodeeltjes uit 2,1 miljoen mogelijke combinaties.
De onderzoekers selecteerden zes nanodeeltjes voor verdere validatie, waaronder een samengesteld uit sorafenib, een behandeling die vaak wordt gebruikt voor gevorderde lever- en andere kankers, en glycyrrhizine, een verbinding die vaak wordt gebruikt als voedings- en medicijnadditief en meestal bekend staat als zoethoutaroma. Hoewel sorafenib de standaardbehandeling is voor gevorderde leverkanker, de effectiviteit ervan is beperkt.
In menselijke leverkankercelculturen, de sorafenib-glycyrrhizine-nanodeeltjes werkten twee keer zo goed als sorafenib alleen, omdat er meer van het medicijn in de cellen kon komen. Werken met de preklinische modellering, Imaging- en testfaciliteit bij het Koch Institute, onderzoekers behandelden muismodellen van leverkanker om de effecten van sorafenib-glycyrrhizine-nanodeeltjes te vergelijken met beide verbindingen op zich. Ze ontdekten dat het nanodeeltje de niveaus van een marker die geassocieerd is met de progressie van leverkanker significant verlaagde in vergelijking met muizen die alleen sorafenib kregen. en leefden langer dan muizen die alleen sorafenib of glycyrrhizine kregen. Het sorafenib-glycyrrhizine-nanodeeltje vertoonde ook een verbeterde targeting op de lever in vergelijking met orale toediening van sorafenib, de huidige standaard in de kliniek, of bij het injecteren van sorafenib nadat het is gecombineerd met cremophor, een veelgebruikte medicijndrager die de oplosbaarheid in water verbetert, maar toxische bijwerkingen heeft.
Gepersonaliseerde medicijnbezorging
Het nieuwe platform kan nuttige toepassingen hebben die verder gaan dan het optimaliseren van de efficiëntie van actieve geneesmiddelen:het zou kunnen worden gebruikt om inactieve verbindingen aan te passen aan de behoeften van individuele patiënten. In eerder werk, leden van het team ontdekten dat inactieve ingrediënten bij sommige patiënten allergische reacties konden veroorzaken. Nutsvoorzieningen, met de uitgebreide machine learning toolbox, er zouden meer opties kunnen worden gegenereerd om alternatieven voor deze patiënten te bieden.
"We hebben de mogelijkheid om na te denken over het afstemmen van het toedieningssysteem op de patiënt, " legt Reker uit, nu een assistent-professor biomedische technologie aan de Duke University. "We kunnen rekening houden met zaken als de opname van medicijnen, genetica, zelfs allergieën om bijwerkingen bij levering te verminderen. Wat de mutatie of medische aandoening ook is, het juiste medicijn is pas het juiste medicijn als het ook echt werkt voor de patiënt."
De tools voor veilig, effectieve medicijnafgifte bestaat, maar het samenvoegen van alle ingrediënten kan een langzaam proces zijn. De combinatie van machine learning, snelle screening, en het vermogen om interacties tussen verschillende combinaties van materialen te voorspellen, zal het ontwerp van medicijnen en de nanodeeltjes die worden gebruikt om ze door het hele lichaam af te leveren, versnellen.
Bij lopende werkzaamheden, het team is niet alleen op zoek naar het verbeteren van de effectieve toediening van medicijnen, maar ook naar mogelijkheden om medicijnen te maken voor mensen voor wie standaardformuleringen geen goede optie zijn, big data gebruiken om problemen in kleine populaties op te lossen door naar genetische geschiedenis te kijken, allergieën, en voedselreacties.
Dit verhaal is opnieuw gepubliceerd met dank aan MIT News (web.mit.edu/newsoffice/), een populaire site met nieuws over MIT-onderzoek, innovatie en onderwijs.
 Hoe te vertellen of een reactie zal optreden
Hoe te vertellen of een reactie zal optreden Biomaterialen met Frankenstein-eiwitten helpen weefsel te genezen
Biomaterialen met Frankenstein-eiwitten helpen weefsel te genezen Nieuwe printtechniek gebruikt cellen en moleculen om biologische structuren na te bootsen
Nieuwe printtechniek gebruikt cellen en moleculen om biologische structuren na te bootsen Hoe een functionele moleculaire machine te coderen?
Hoe een functionele moleculaire machine te coderen? Betaalbare katalysator voor recycling van kooldioxide
Betaalbare katalysator voor recycling van kooldioxide
 NASA-NOAA-satelliet ziet Erick nog steeds hangen als een orkaan
NASA-NOAA-satelliet ziet Erick nog steeds hangen als een orkaan Hoe het oogsten van natuurlijke producten mensen op het platteland kan helpen de armoede te verslaan
Hoe het oogsten van natuurlijke producten mensen op het platteland kan helpen de armoede te verslaan Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit
Wat is een derecho? Een atmosferische wetenschapper legt deze zeldzame maar gevaarlijke stormsystemen uit Misleidende mulch:onderzoekers vinden dat de inhoud van mulchzakken niet overeenkomt met de beweringen
Misleidende mulch:onderzoekers vinden dat de inhoud van mulchzakken niet overeenkomt met de beweringen Nieuwe methode laat wetenschappers dieper in de oceaan turen
Nieuwe methode laat wetenschappers dieper in de oceaan turen
Hoofdlijnen
- Neanderthaler DNA veranderde de manier waarop moderne mensen eruitzien
- Verschillen tussen Protozoa en Protisten
- Samengestelde ogen een continu kenmerk van evolutie
- In beweging blijven - platte wormen werpen licht op de rol van migrerende stamcellen bij kanker
- Braziliaanse onderzoekers ontdekken zes nieuwe soorten zijdemiereneter
- Onderzoek naar superstil gemaakte DNA hints naar nieuwe manieren om cellen te herprogrammeren
- Wat zijn de vijf klassen van immunoglobulinen?
- Hoe neemt een slijmvorm beslissingen zonder hersenen?
- Waarom is de studie van de histologie belangrijk in uw algehele begrip van anatomie en fysiologie?
- Op grafeen gebaseerde materialen doden bacteriën via een van de twee mogelijke mechanismen

- Onderzoekers ontwikkelen derde en laatste op bestelling gemaakte nanobuissynthesetechniek
- Levende cellen en batterijen:met een beetje grafeen kom je een heel eind

- Bio-geïnspireerde koolstofanoden maken hoge prestaties mogelijk in lithium-ionbatterijen

- Houtspons neemt olie op uit water
 Geïntegreerde waterstofopslag voor brandstofcelauto's
Geïntegreerde waterstofopslag voor brandstofcelauto's Veel Amerikanen geloven valse verkiezingsverhalen, enquête toont
Veel Amerikanen geloven valse verkiezingsverhalen, enquête toont Onderzoekers ontwikkelen betere methode om giftige kleurstoffen uit afvalwater te verwijderen
Onderzoekers ontwikkelen betere methode om giftige kleurstoffen uit afvalwater te verwijderen Een sprong in het continuüm
Een sprong in het continuüm Draagbare sensoren die gaslekken detecteren
Draagbare sensoren die gaslekken detecteren Het domein van een vierkantswortelfunctie vinden
Het domein van een vierkantswortelfunctie vinden Grafeen ziet er veelbelovend uit voor toekomstige spintronische apparaten
Grafeen ziet er veelbelovend uit voor toekomstige spintronische apparaten Wat zijn enkele positieve en negatieve gevolgen bij aardbevingen?
Wat zijn enkele positieve en negatieve gevolgen bij aardbevingen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | Italian |

-
Wetenschap © https://nl.scienceaq.com

