
Wetenschap
Waarom binden ziekenhuisbacteriën zich sterker aan bepaalde oppervlakken dan aan andere?
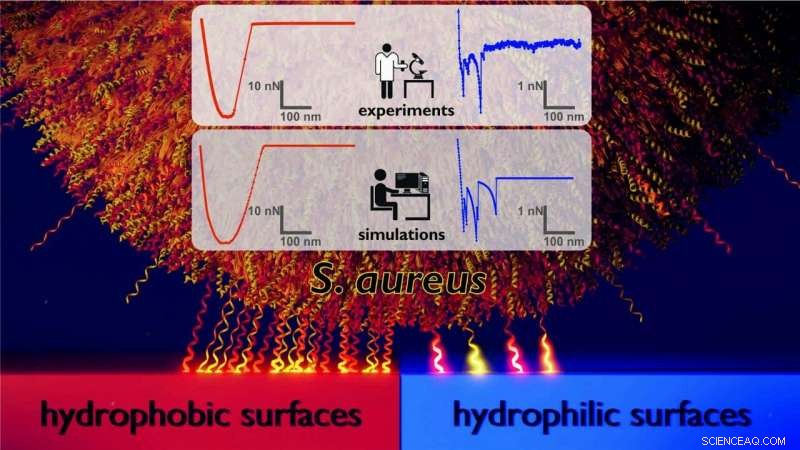
Model van het adhesiemechanisme waarmee de bacterie Staphylococcus aureus zich bindt aan hydrofobe ('low-energy') oppervlakken (links) vergeleken met hydrofiele ('high-energy') oppervlakken (rechts). Aan je linker kant, een groot aantal celwandmoleculen (hier weergegeven als kleine samendrukbare veren) zijn betrokken bij het binden van de cel aan het hydrofobe oppervlak. Op het hydrofiele oppervlak rechts, er zijn veel minder moleculen bij betrokken. De resultaten zijn verkregen door een team van experimentele en theoretische natuurkundigen aan de Universiteit van Saarland die computationele Monte Carlo-simulaties uitvoerden van kracht-afstandsgegevens van atomaire krachtmicroscopie-experimenten. Krediet:Universiteit van Saarland
Resultaten van studies in zowel experimentele als theoretische fysica kunnen helpen om antibacteriële oppervlakken te verbeteren. Het onderzoekswerk is onlangs gepubliceerd in het tijdschrift nanoschaal .
Staphylococcus aureus bacteriën zijn een van de meest voorkomende oorzaken van infecties die patiënten oplopen tijdens een ziekenhuisverblijf. Deze pathogenen zijn bijzonder problematisch omdat ze robuuste biofilms kunnen vormen op zowel natuurlijke als kunstmatige oppervlakken waarvan ze zeer moeilijk te verwijderen zijn. "De individuele bacteriën in deze biofilms worden effectief beschermd tegen aanvallen door antibiotica of door het menselijk immuunsysteem. Daarom kan het zo gevaarlijk zijn wanneer deze bacteriën medische implantaten koloniseren, omdat ze dan ernstige postoperatieve infecties kunnen veroorzaken, " legt Karin Jacobs uit, Hoogleraar Experimentele Fysica aan de Universiteit van Saarland. Het is daarom van cruciaal belang om te proberen de vorming van deze biofilms in de eerste plaats te voorkomen.
Echter, om biofilmgroei te kunnen beïnvloeden, de onderzoekers moesten de mechanismen begrijpen waarmee de bacteriën zich aan verschillende materialen hechten. Met behulp van een scanning atomic force microscoop, ze drukten de minuscule bacteriecellen op verschillende soorten oppervlakken en bepaalden vervolgens de kracht die nodig was om de vastgehechte cellen van het oppervlak te tillen. Deze experimentele configuratie stelde de onderzoekers in staat om zogenaamde kracht-afstandscurven vast te leggen. "We gebruikten extreem gladde siliciumoppervlakken als modeloppervlakken. In één reeks experimenten, de siliciumoppervlakken werden zodanig geprepareerd dat ze een hoge waterbevochtigbaarheid hadden; in een andere reeks experimenten werden ze als zeer hydrofoob behandeld. We konden aantonen dat de bacteriecellen veel sterker hechtten aan de hydrofobe oppervlakken, waar het water gewoon van af rolde, dan op de hydrofiele (waterbevochtigbare) oppervlakken, " legt Karin Jacobs uit.
Maar het is niet alleen de grootte van de krachten die verschillen tussen de twee oppervlaktetypes, dat geldt ook voor de vormen van de kracht-afstandscurven (zie afbeelding). "Op de hydrofobe oppervlakken, we zien zeer vloeiende rondingen met een karakteristieke komvorm. Op de hydrofiele oppervlakken, in tegenstelling tot, we observeren kracht-afstandscurven met een zeer gekarteld profiel, ’ zegt professor Jacobs.
Om deze resultaten te begrijpen, de dynamiek van deze complexe systemen werd gemodelleerd met behulp van Monte Carlo-simulaties die werden uitgevoerd in de onderzoeksgroep onder leiding van professor Ludger Santen, Hoogleraar theoretische fysica aan de Universiteit van Saarland. Het model behandelt de bacteriële cel als een stijve bol en de moleculen in de celwand die de cel aan het oppervlak binden als minuscule veertjes. "Het blijkt dat om de experimentele resultaten te reproduceren, de rol van de willekeurige (stochastische) aard van het moleculaire bindingsproces is belangrijker dan proberen de complexiteit van het model te vergroten. We hebben nu ontdekt waarom de bacteriecellen zich zo verschillend gedragen op verschillende soorten oppervlakken. Op hydrofobe oppervlakken, een groot aantal celwandeiwitten hecht zich aan het oppervlak, wat resulteert in een sterke bindende kracht en een vloeiende kracht-afstandscurve oplevert, ", legt Ludger Santen uit.
In tegenstelling tot, op een hydrofiel oppervlak, veel minder celwandeiwitten zijn betrokken bij het binden van de bacterie aan het oppervlak. Als resultaat, de bacteriën worden minder sterk aan het oppervlak vastgehouden en de vorm van de kracht-afstandscurve is minder uniform. "De gekartelde vorm van de rondingen die we zien bij hydrofiele oppervlakken wordt veroorzaakt door een paar individuele celwandmoleculen als ze van het oppervlak worden getrokken. Omdat er minder celwandeiwitten bij betrokken zijn, de bacteriën binden minder sterk aan hydrofiele oppervlakken, " zegt Erik Maikranz, die de Monte Carlo-simulaties uitvoerde als onderdeel van zijn promotieonderzoek.
Door de verschillende vormen van de kracht-afstandscurven, de natuurkundigen veronderstellen dat op een hydrofiel oppervlak minder celwandeiwitten betrokken zijn bij het bindingsproces omdat deze moleculen eerst een potentiële barrière moeten overwinnen, wat effectief het aantal eiwitmacromoleculen vermindert dat de cel aan het oppervlak kan binden. "De potentiële barrière voor hechting op hydrofiele oppervlakken is relatief hoog, dus slechts enkele van de celwandeiwitten zijn in staat om deze energiebarrière in een bepaalde tijd te overwinnen. Op hydrofobe oppervlakken, echter, de drempel is verwaarloosbaar klein, zodat veel celwandeiwitten zich direct aan het oppervlak kunnen hechten, " legt Dr. Christian Spengler uit, die de experimenten in het onderzoek heeft uitgevoerd.
 De gemiddelde atoommassa
De gemiddelde atoommassa Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars
Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars Onderzoekers lokaliseren de grootste celreceptor van het lichaam
Onderzoekers lokaliseren de grootste celreceptor van het lichaam Wetenschapsprojecten: Welke kaas smelt sneller?
Wetenschapsprojecten: Welke kaas smelt sneller?  Afstemmen op de LCD's van morgen:de nieuwe IGZO-11 halfgeleider verkennen
Afstemmen op de LCD's van morgen:de nieuwe IGZO-11 halfgeleider verkennen
 Sri Lanka keert biologische landbouw terug terwijl thee lijdt
Sri Lanka keert biologische landbouw terug terwijl thee lijdt Model voor het voorspellen van een sneeuwlaag in de bergen geeft een duidelijker beeld van de afvoer in het voorjaar, gevolgen van klimaatverandering
Model voor het voorspellen van een sneeuwlaag in de bergen geeft een duidelijker beeld van de afvoer in het voorjaar, gevolgen van klimaatverandering Verbeterde weergaven van aardtektoniek
Verbeterde weergaven van aardtektoniek Leider van de Marshalleilanden roept op om hulp bij klimaatverandering
Leider van de Marshalleilanden roept op om hulp bij klimaatverandering Regenwater-oogst-projecten voor kinderen
Regenwater-oogst-projecten voor kinderen
Hoofdlijnen
- Goud zeven uit de datastroom
- Misplaatste monarchen:clusters van vlinders in het noorden
- 25 nieuwe genomen om 25 jaar Sanger Institute te vieren
- Twee zeldzame aanvallen van zeeleeuwen sluiten baai in San Francisco Bay af
- Drie van de meest bizarre relaties van de natuur
- Nieuwe oude dolfijnsoort Urkudelphis chawpipacha ontdekt in Ecuador
- Gestresste stokstaartjes helpen minder snel groep
- Diepe wortels in planten aangedreven door bodemhydrologie
- Wat zijn enkele kenmerken van DNA?
- SuperSTEM-onderzoek onthult dat grafeen zijn gaten opnieuw breit

- Regulering van het absorptiespectrum van polydopamine

- Berkeley Lab-wetenschappers maken moleculair papier (met video)

- Onderzoekers smartphone-microscoop kan een enkel virus detecteren, nanodeeltjes

- Koperen nanodraden bieden een efficiënte, goedkope benadering van het oogsten van zonne-energie

 IPCC-rapport:Hoe de wereldwijde uitstoot pieken en dalen – en wat houdt ons tegen?
IPCC-rapport:Hoe de wereldwijde uitstoot pieken en dalen – en wat houdt ons tegen? Zal de oceaan profiteren van de strijd om het verbod op microbeads?
Zal de oceaan profiteren van de strijd om het verbod op microbeads? NASA ziet Maria intensiveren tot een grote orkaan
NASA ziet Maria intensiveren tot een grote orkaan NOAA-NASA Suomi NPP vangt branden en spuitbussen in heel Amerika op
NOAA-NASA Suomi NPP vangt branden en spuitbussen in heel Amerika op Voor Ghana recyclers van e-waste, een veiligere optie te midden van giftige dampen
Voor Ghana recyclers van e-waste, een veiligere optie te midden van giftige dampen EPA is van plan de regelgeving inzake methaanemissies op te heffen, rapporten zeggen:
EPA is van plan de regelgeving inzake methaanemissies op te heffen, rapporten zeggen: Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit
Nieuwe ontdekking daagt lang gekoesterde evolutietheorie uit Gelaagdheid in café lattes levert inzichten op voor engineering, geneeskunde en milieu
Gelaagdheid in café lattes levert inzichten op voor engineering, geneeskunde en milieu
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

