
Wetenschap
Bioactieve nanocapsules om celgedrag te kapen
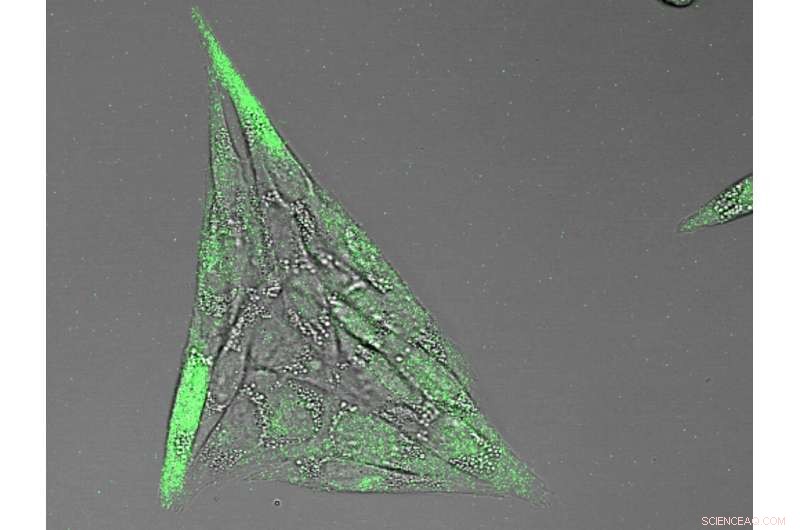
Enzym-geladen nanocapsules werken samen. Het calciumgehalte in de cellen (groene fluorescentie) dient als een indicator dat het systeem werkt. Krediet:Universiteit van Bazel, Afdeling Chemie
Veel ziekten worden veroorzaakt door defecten in signaalroutes van lichaamscellen. In de toekomst, bioactieve nanocapsules kunnen een waardevol hulpmiddel worden voor medicijnen om deze routes te beheersen. Onderzoekers van de Universiteit van Basel hebben een belangrijke stap in deze richting gezet:ze slagen erin om verschillende nanocapsules samen te laten werken om een natuurlijke signaalcascade te versterken en het celgedrag te beïnvloeden.
Cellen communiceren constant met elkaar en hebben manieren om signalen op te vangen en te verwerken - vergelijkbaar met mensen die oren nodig hebben om geluiden te horen en kennis van taal om hun betekenis te verwerken. Het beheersen van de eigen signaalroutes van de cel is van groot belang voor de geneeskunde om verschillende ziekten te behandelen.
Een onderzoeksteam van de afdeling Scheikunde van de Universiteit van Basel en de NCCR Molecular Systems Engineering ontwikkelt bioactieve materialen die hiervoor geschikt zouden kunnen zijn. Om dit te behalen, de onderzoekers onder leiding van professor Cornelia Palivan combineren nanomaterialen met natuurlijke moleculen en cellen.
In het journaal ACS Nano , ze rapporteren nu hoe met enzymen geladen nanocapsules cellen kunnen binnendringen en kunnen worden geïntegreerd in hun oorspronkelijke signaleringsprocessen. Door verschillende nanocapsules functioneel te koppelen, ze zijn in staat om een natuurlijke signaalroute te versterken.
Bescherming van de lading
Om de enzymen te beschermen tegen afbraak in een cellulaire omgeving, heeft het onderzoeksteam ze in kleine polymere capsules geladen. Moleculen kunnen het compartiment binnendringen via biologische poriën die specifiek in de synthetische wand zijn ingebracht en reageren met de enzymen erin.
De onderzoekers voerden experimenten uit met nanocapsules die verschillende enzymen herbergen die samenwerkten:het product van de eerste enzymatische reactie ging een tweede capsule binnen en startte de tweede reactie binnenin. Deze nanocapsules konden dagenlang werkzaam blijven en actief deelnemen aan natuurlijke reacties in zoogdiercellen.
Kleine luidsprekers en oren
Een van de vele signalen die cellen ontvangen en verwerken is stikstofmonoxide (NO). Het is een goed bestudeerd cellulair mechanisme, aangezien defecten in de NO-signaleringsroute betrokken zijn bij het ontstaan van hart- en vaatziekten, maar ook bij spier- en retinale dystrofieën. De route omvat de productie van NO door een enzymfamilie die stikstofoxidesynthasen (NOS) wordt genoemd. Het NO kan dan diffunderen naar andere cellen waar het wordt waargenomen door een ander enzym genaamd oplosbaar guanylaatcyclase (sGC). De activering van sGC start een cascadereactie, het reguleren van een overvloed aan verschillende processen, zoals het ontspannen van gladde spieren en de verwerking van licht door sensorische cellen, onder andere.
De onderzoekers onder leiding van Palivan produceerden capsules met NOS en sGC, die van nature aanwezig zijn in cellen, maar in veel lagere concentraties:de NOS-capsules, NEE produceren, werken op dezelfde manier als luidsprekers, hun signaal luid en duidelijk 'schreeuwen'; de sGC-capsules, fungeren als 'oren, ' detecteren en verwerken van het signaal om de respons te versterken.
Met behulp van de intracellulaire concentratie van calcium, die afhangt van de actie van sGC, als indicatie, de wetenschappers toonden aan dat de combinatie van zowel NOS- als sGC-geladen capsules de cellen veel reactiever maakt, met een 8-voudige verhoging van het intracellulaire calciumgehalte.
Een nieuwe strategie voor enzymvervangingstherapie
"Het is een nieuwe strategie om dergelijke veranderingen in cellulaire fysiologie te stimuleren door nanowetenschap te combineren met biomoleculen, " zegt Dr. Andrea Belluati, de eerste auteur van de studie. "We moesten gewoon onze met enzymen beladen capsules met de cellen incuberen, en ze waren klaar om in een oogwenk te handelen".
"Deze proof of concept is een belangrijke stap op het gebied van enzymvervangingstherapie voor ziekten waarbij biochemische routes slecht werken, zoals hart- en vaatziekten of verschillende dystrofieën, ", voegt Cornelia Palivan toe.
Hoofdlijnen
- Sumatraanse tijgers op weg naar herstel in gevaar UNESCO-werelderfgoed
- Microbiële ziekten en mutaties: wat is het ?, Lijsten & Oorzaken
- Wat gebruiken chloroplasten om glucose te maken?
- Music Science Fair Project Ideas
- Hoe kan een babyrobotzeehond een medisch hulpmiddel zijn?
- Soorten redeneren in geometrie
- Duizenden burgerwetenschappers helpen onderzoekers kelpbossen in kaart te brengen
- Mosquito-seks-eiwit kan de sleutel zijn tot het beheersen van ziekten
- Live hersenactiviteit volgen met de nieuwe NeuBtracker open-source microscoop
- Iriserende films gemaakt van houtpulpcellulose kunnen giftige kleurstoffen vervangen
- Hoe nanowetenschap onze gezondheid en ons leven de komende jaren zal verbeteren

- Kwantumeffecten in metalen structuren op nanometerschaal

- Door licht geïnduceerde vormverschuiving van MXenes
- Organische elektronische apparaten kunnen op gewone cd's en dvd's worden afgedrukt

 Weten we echt meer over de ruimte dan de diepe oceaan?
Weten we echt meer over de ruimte dan de diepe oceaan?  Informaticalessen doorbreken culturele barrières, studie toont
Informaticalessen doorbreken culturele barrières, studie toont Een minerale spons gebruiken om uranium op te vangen
Een minerale spons gebruiken om uranium op te vangen Supernova-tweeling opent nieuwe mogelijkheden voor precisiekosmologie
Supernova-tweeling opent nieuwe mogelijkheden voor precisiekosmologie Onderzoekers ontwerpen intelligent metamateriaal om MRI's betaalbaar en toegankelijk te maken
Onderzoekers ontwerpen intelligent metamateriaal om MRI's betaalbaar en toegankelijk te maken Is delen op sociale media het nieuwe normaal?
Is delen op sociale media het nieuwe normaal? China lanceert zijn eerste röntgenruimtetelescoop
China lanceert zijn eerste röntgenruimtetelescoop Take 2:Ruimtewandelende astronauten installeren nieuw zonnepaneel
Take 2:Ruimtewandelende astronauten installeren nieuw zonnepaneel
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


