
Wetenschap
Een genetische nano-toolkit voor het genereren van nieuwe biomaterialen
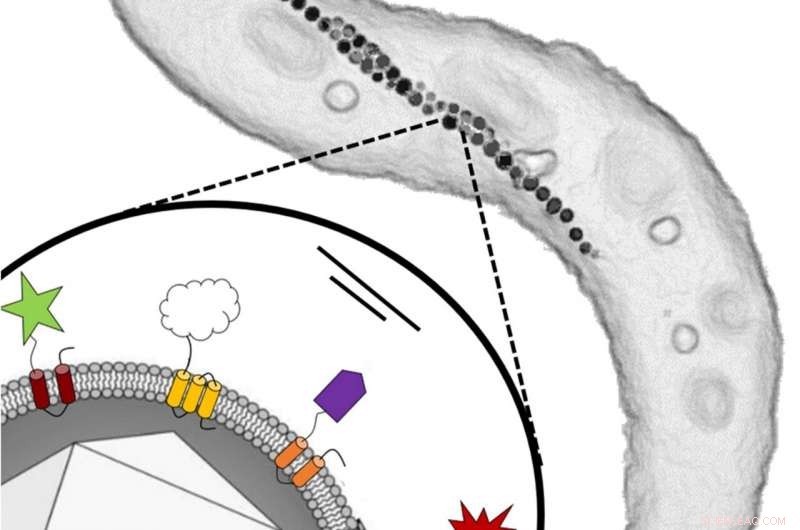
Rechtsboven:Schema van een cel van de magnetische bacterie Magnetospirillum gryphiswaldense die in dit onderzoek is gebruikt, toont zijn intracellulaire keten van magnetosoomdeeltjes. Elke cel heeft een lengte tussen drie en vijf micrometer. Linksonder:Enkel magnetosoom met een ijzeroxide kern omhuld door een membraan. Verschillende functionele groepen van vreemde organismen werden genetisch gefuseerd met specifieke eiwitten van het magnetosoommembraan. Krediet:Frank Mickoleit / Clarissa Lanzloth
Magnetische bacteriën kunnen binnenkort worden gebruikt voor de productie van nieuwe biomaterialen. Een team van microbiologen aan de Universiteit van Bayreuth onder leiding van Prof. Dr. Dirk Schüler ontwikkelde een modulair systeem voor de genetische herprogrammering van bacteriën, waardoor de organismen veranderen in celfabrieken voor multifunctionele magnetische nanodeeltjes die verschillende nuttige functies en eigenschappen combineren. Vanwege hun uitzonderlijke magnetische eigenschappen en goede biocompatibiliteit, deze nanodeeltjes kunnen een veelbelovend nieuw materiaal zijn op biomedisch en biotechnologisch gebied. In het journaal Klein de wetenschappers presenteerden hun bevindingen.
Van magnetosomen tot veelzijdige nanodeeltjes
Magnetische bacteriën van de soort Magnetospirillum gryphiswaldense stemmen hun zwemgedrag af op het aardmagnetisch veld. Binnen de cellen, magnetische nanodeeltjes, de magnetosomen, zijn op een kettingachtige manier gerangschikt, waardoor een intracellulaire kompasnaald wordt gevormd. Elk magnetosoom bestaat uit een magnetische ijzeroxidekern omgeven door een membraan. Naast lipiden, dit membraan bevat ook een verscheidenheid aan verschillende eiwitten. De microbiologen van de Universiteit van Bayreuth zijn er nu in geslaagd om biochemisch actieve functionele groepen te koppelen, die afkomstig zijn van verschillende vreemde organismen, aan deze eiwitten. De hier gebruikte methode begint bij het stadium van de genen die verantwoordelijk zijn voor de biosynthese van de membraaneiwitten. Deze bacteriële genen worden gefuseerd met vreemde genen van andere organismen die de productie van de respectieve functionele eiwitten regelen. Zodra de genen opnieuw in het genoom zijn geïntegreerd, de geherprogrammeerde bacteriën produceren magnetosomen die deze vreemde eiwitten permanent op het deeltjesoppervlak installeren.
In de studie, vier verschillende functionele groepen (d.w.z. vreemde eiwitten) werden aan de membraaneiwitten gekoppeld. Deze omvatten het enzym glucose-oxidase van een schimmelschimmel, die al biotechnologisch wordt gebruikt, bijvoorbeeld als "suikersensor" bij diabetesziekten. In aanvulling, een groen fluorescerend eiwit van een kwal en een kleurstofproducerend enzym van de bacterie Escherichia coli, waarvan de activiteit gemakkelijk kan worden gemeten, werden geïnstalleerd op het oppervlak van de magnetosomen. De vierde functionele groep is een antilichaamfragment van een lama (Alpaca) dat als veelzijdige connector werd gebruikt. Dus, al deze eigenschappen, inclusief de uitstekende magnetisatie van de magnetosomen, zijn genetisch gecodeerd in de bacteriën.
"Met behulp van deze genetische strategie, we hebben de bacteriën geherprogrammeerd om magnetosomen te produceren die groen gloeien wanneer ze worden bestraald met UV-licht en tegelijkertijd nieuwe biokatalytische functies vertonen. Verschillende biochemische functies kunnen nauwkeurig op hun oppervlakken worden geïnstalleerd. Daarbij, magnetosomen van levende bacteriën worden omgezet in multifunctionele nanodeeltjes met fascinerende functies en eigenschappen. Bovendien, de deeltjes blijven volledig functioneel wanneer ze worden geïsoleerd van de bacteriën - wat gemakkelijk kan worden gedaan door gebruik te maken van hun inherente magnetische eigenschappen, " zegt professor Dirk Schüler, die het onderzoeksteam leidde.
Een genetische toolkit voor toepassingen in de biogeneeskunde en biotechnologie
Functionalisatie van de magnetosomen is geenszins beperkt tot de functionele groepen die door de Bayreuth-microbiologen op het deeltjesoppervlak zijn geïnstalleerd. In plaats daarvan, deze eiwitten kunnen gemakkelijk worden vervangen door andere functies, waardoor een zeer veelzijdig platform wordt geboden. Genetische herprogrammering opent daarom een breed spectrum om het magnetosoomoppervlak te ontwerpen. Het vormt de basis voor een "genetische toolkit" die de productie van op maat gemaakte magnetische nanodeeltjes mogelijk maakt, het combineren van verschillende nuttige functies en eigenschappen. Elk van deze deeltjes is tussen de drie en vijf nanometer groot.
"Onze benadering van genetische manipulatie is zeer selectief en nauwkeurig, in vergelijking tot, bijvoorbeeld, chemische koppelingstechnieken die niet zo efficiënt zijn en deze hoge mate van controle missen, " legt de Bayreuth-microbioloog Dr. Frank Mickoleit uit, de eerste auteur van de studie. Hij wijst op een beslissend voordeel van de nieuwe biomaterialen:"Eerdere studies tonen aan dat de magnetische nanodeeltjes waarschijnlijk niet schadelijk zijn voor celculturen. Een goede biocompatibiliteit is een belangrijke voorwaarde voor de toekomstige toepassing van de deeltjes in de biogeneeskunde, bijvoorbeeld als contrastmiddel in magnetische beeldvormingstechnieken of als magnetische sensoren in diagnostiek. In de toekomst, bijvoorbeeld, vergelijkbare deeltjes kunnen helpen om tumorcellen op te sporen en te vernietigen. Bioreactorsystemen zijn een ander toepassingsgebied. Magnetische nanodeeltjes uitgerust met minuscule katalysatoren zouden hiervoor zeer geschikt zijn en complexe biochemische processen mogelijk maken.
"Er is een enorm toepassingspotentieel voor nanodeeltjes die verschillende functionele groepen op het oppervlak vertonen, met name op het gebied van biotechnologie en biogeneeskunde. De magnetische bacteriën kunnen nu dienen als platform voor een veelzijdige nano-toolkit, inspirerende wetenschappelijke creativiteit op het gebied van synthetische biologie. Het zal verdere interessante onderzoeksbenaderingen initiëren, ", voegt microbioloog Clarissa Lanzloth B.Sc., die als co-auteur betrokken was bij de nieuwe studie tijdens het afronden van haar masterscriptie in biochemie en moleculaire biologie in Bayreuth.
 Hoe bereken ik molariteit?
Hoe bereken ik molariteit?  Onderzoekers ontdekken een verband tussen twee belangrijke producten van stikstofmonoxide
Onderzoekers ontdekken een verband tussen twee belangrijke producten van stikstofmonoxide Rioolgas omzetten in schone waterstofbrandstof
Rioolgas omzetten in schone waterstofbrandstof Het in kaart brengen van de driedimensionale structuur van katalytische centra helpt bij het ontwerpen van nieuwe en verbeterde katalysatoren
Het in kaart brengen van de driedimensionale structuur van katalytische centra helpt bij het ontwerpen van nieuwe en verbeterde katalysatoren Onderzoekers produceren biobrandstof voor conventionele dieselmotoren
Onderzoekers produceren biobrandstof voor conventionele dieselmotoren
 Spaanse Canarische Eilanden vechten glad na veerbootongeluk
Spaanse Canarische Eilanden vechten glad na veerbootongeluk Kun je een hogedrukreiniger met een regenton gebruiken?
Kun je een hogedrukreiniger met een regenton gebruiken?  Genen ontsluiten aanwijzingen voor de evolutie en overleving van het Great Barrier Reef
Genen ontsluiten aanwijzingen voor de evolutie en overleving van het Great Barrier Reef Afvang en opslag van koolstof kan de uitstoot snel verminderen in sectoren die weinig andere opties hebben
Afvang en opslag van koolstof kan de uitstoot snel verminderen in sectoren die weinig andere opties hebben 6 stappen over hoe wolken worden gevormd
6 stappen over hoe wolken worden gevormd
Hoofdlijnen
- Zeldzame zangvogel heeft misschien nooit bestaan
- Hoe beïnvloeden je hersenen je overlevingskansen in de wildernis?
- Alles-in-één reparatiekit maakt CRISPR-genbewerking nauwkeuriger
- Hoe werken Mexicaanse springbonen?
- Een ingenieursgids voor het embryo
- Het verlichten van sojabladeren kan de voedselvoorziening stimuleren
- Onderzoek onthult hoe verontreinigende stoffen de vroege embryonale ontwikkeling beïnvloeden
- Wat is ureum?
- Familiebanden Snapper leveren nieuw bewijs op over mariene reservaten
- Magnetisch bestuurde batterij kan energie opslaan voor elektriciteitsnetten

- Kleppen voor kleine deeltjes

- Magnetisch vortexgeheugen toont geheugenpotentieel van nanodots
- Thermotrope fasegrenzen in klassieke ferro-elektriciteit
- Lang en smal, vrij van gebreken, en oplosbaar:grafeen nanoribbons door bottom-up synthese
 De effecten van tyfonen
De effecten van tyfonen  Doorbraak microscopie onthult hoe eiwitten zich gedragen in 3-D
Doorbraak microscopie onthult hoe eiwitten zich gedragen in 3-D Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee
Van verstrikking tot invasies van uitheemse soorten - de schade veroorzaakt door zwerfvuil op zee Beeldvorming met de snelheid van het licht
Beeldvorming met de snelheid van het licht Online cursussen versterken ongelijkheden
Online cursussen versterken ongelijkheden Dit is wat de wetenschap zegt over dierengevoel
Dit is wat de wetenschap zegt over dierengevoel Mysterie van 8, 500 jaar oud evenement voor het maken van koper onthuld door materiaalwetenschap
Mysterie van 8, 500 jaar oud evenement voor het maken van koper onthuld door materiaalwetenschap Meer bestrating, meer overstromingsproblemen
Meer bestrating, meer overstromingsproblemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Spanish | Portuguese | German | Dutch | Danish | Norway | Italian | Swedish |

-
Wetenschap © https://nl.scienceaq.com

