
Wetenschap
Gouden nanodeeltjes onthullen amyloïde fibrillen
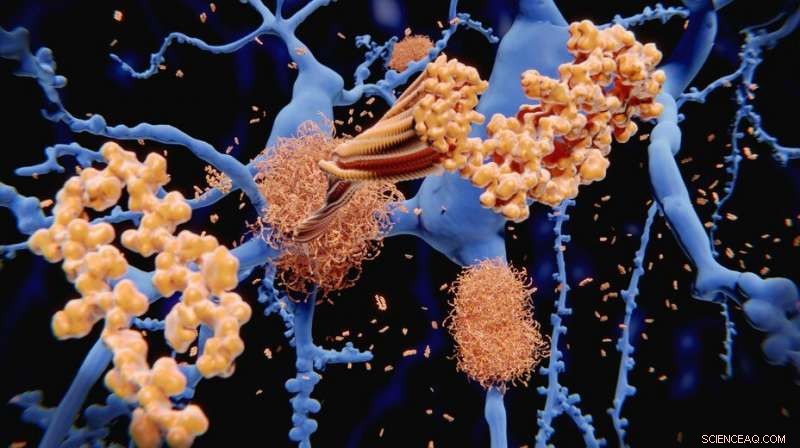
Het amyloïde-bèta-peptide hoopt zich op tot amyloïde fibrillen die dichte amyloïde plaques opbouwen. Krediet:selvanegra. Krediet:iStock-foto's
EPFL-wetenschappers hebben krachtige hulpmiddelen ontwikkeld om de diversiteit van amyloïde fibrillen te ontmaskeren, die geassocieerd zijn met de ziekte van Alzheimer en andere neurodegeneratieve aandoeningen. De wetenschappers maakten de doorbraak door gouden nanodeeltjes te ontwikkelen die gecombineerd worden met cryogene transmissie-elektronenmicroscopie, om snelle en ongekende beelden van fibrillen te bieden.
Een van de kenmerken van de ziekte van Alzheimer is de aanwezigheid van knoopachtige structuren tussen hersencellen. Deze worden "amyloïde fibrillen" genoemd en worden gevormd door het beruchte amyloïde beta-peptide en Tau-eiwit, die twee van de meest gewilde doelen zijn voor de ontwikkeling van therapieën voor de behandeling van de ziekte van Alzheimer en soortgelijke ziekten.
Zowel amyloïde bèta als Tau worden normaal gesproken in de hersenen geproduceerd. Echter, deze eiwitten kunnen met elkaar verstrikt raken om omvangrijke fibrilstructuren te vormen. Wanneer dit gebeurt, ze geven aanleiding tot aandoeningen zoals de ziekte van Alzheimer en andere neurodegeneratieve ziekten.
De fibrilstructuren verspreiden zich door de hersenen door van de ene cel naar de andere te gaan. Men denkt dat dit leidt tot degeneratie van neuronen, hersenbeschadiging en cognitieve stoornissen zoals geheugenverlies, en onderzoeksinspanningen waren over het algemeen gericht op het blokkeren van deze processen om de progressie van de ziekte te vertragen.
We weten nu dat deze amyloïde fibrillen in meerdere vormen en structuren kunnen voorkomen die verschillende verschillende eigenschappen vertonen, wat kan verklaren waarom patiënten met de ziekte van Alzheimer en Parkinson verschillende klinische symptomen vertonen. Daarom, het vastleggen van deze diversiteit en het correleren met ziektesymptomen bij mensen of de biologische activiteit van deze soorten in ziektemodellen heeft belangrijke implicaties voor het begrijpen van ziektemechanismen en het ontwikkelen van nieuwe therapieën en diagnostiek.
Gezien het belang van amyloïde fibrillen, er zijn veel pogingen gedaan om ze zo gedetailleerd mogelijk te visualiseren om inzicht te krijgen in hun structuur. Het ontrafelen van hun structurele details zou mogelijk kunnen leiden tot het opsporen van zwakke plekken die het doelwit kunnen zijn voor behandeling en de weg vrijmaken voor het ontwikkelen van betrouwbaardere diagnostische hulpmiddelen. Ondanks veel werk, echter, het afbeelden en vastleggen van de diversiteit van fibrillen in biologische monsters is zeer moeilijk gebleken vanwege hun complexe aard en heterogeniteit.
De weg van goud (nanodeeltjes)
Nutsvoorzieningen, wetenschappers van de groepen van Francesco Stellacci en Hilal Lashuel van EPFL hebben een oplossing gevonden. In een baanbrekend artikel gepubliceerd in PNAS , laten de onderzoekers zien dat gouden amfifiele anionische nanodeeltjes met een diameter van ongeveer 3 nm, hebben een uniek vermogen om de rand van amyloïde fibrillen efficiënt te labelen in een gehydrateerde staat. Dit maakt de visualisatie van de diverse amyloïde fibrillen gemakkelijker.
Het onderzoeksproject werd geleid door Ph.D. student Urszula Cendrowska en Dr. Paulo J. Silva.
Dit was mogelijk door de met nanodeeltjes versierde fibrillen af te beelden met behulp van een gespecialiseerde vorm van TEM genaamd "cryogene transmissie-elektronenmicroscopie" (cryo-EM). Het belangrijkste verschil hier is dat bij cryo-EM het monster - hier de fibrillen - eerst snel wordt ingevroren tot een zeer lage temperatuur en in zijn "natuurlijke" staat kan worden gevisualiseerd zonder dat het vooraf moet worden gefixeerd of gekleurd.
Tussen de zeer efficiënte binding van gouden nanodeeltjes en de mogelijkheden van cryo-EM, de wetenschappers waren in staat om beelden van fibrillen te verkrijgen en hun diversiteit met ongekende helderheid te ontmaskeren. Dit omvatte fibrillen die in het laboratorium waren gekweekt, evenals van daadwerkelijke postmortale weefsels van patiënten.
"Onze bevindingen onthullen een opvallend morfologisch verschil tussen de fibrillen geproduceerd in celvrije systemen en die geïsoleerd uit patiënten, " zegt Stellacci. "Dit ondersteunt de huidige opvatting dat de fysiologische omgeving een belangrijke rol speelt bij het bepalen van verschillende soorten amyloïde fibrillen."
"Deze vooruitgang maakt de weg vrij voor het ophelderen van de structurele basis van amyloïde stammen en toxiciteit, " zegt Lashuel. "De nanodeeltjes zijn krachtige en broodnodige hulpmiddelen voor snelle beeldvorming en profilering van amyloïde morfologisch polymorfisme in verschillende soorten monsters onder cryo-omstandigheden, vooral complexe monsters geïsoleerd uit van de mens afgeleide pathologische aggregaten."
 Het gemakkelijker maken om kooldioxide af te vangen in de cementindustrie
Het gemakkelijker maken om kooldioxide af te vangen in de cementindustrie De krachten van elektrochemie en stromingstechnologie samenbrengen
De krachten van elektrochemie en stromingstechnologie samenbrengen Leren van fotosynthese:synthetische circuits kunnen lichtenergie oogsten
Leren van fotosynthese:synthetische circuits kunnen lichtenergie oogsten Keverweegschalen houden geheim voor het maken van duurzame verf van gerecycled plastic, uit onderzoek blijkt
Keverweegschalen houden geheim voor het maken van duurzame verf van gerecycled plastic, uit onderzoek blijkt Overeenkomsten tussen Graphite en Diamonds
Overeenkomsten tussen Graphite en Diamonds
 2020 een van de drie warmste jaren ooit gemeten:UN
2020 een van de drie warmste jaren ooit gemeten:UN Een aardbeving met een kracht van 6,0 op de schaal van Richter doet Indonesië Java, Bali
Een aardbeving met een kracht van 6,0 op de schaal van Richter doet Indonesië Java, Bali Amerikaans onderzoek toont aan dat pesticiden de bedreigde zalm schaden, walvissen
Amerikaans onderzoek toont aan dat pesticiden de bedreigde zalm schaden, walvissen Alles wat blinkt:Ghana strijdt tegen illegale mijnbouw
Alles wat blinkt:Ghana strijdt tegen illegale mijnbouw Onderzoekers versnellen analyse van Arctische ijs- en sneeuwgegevens via AI
Onderzoekers versnellen analyse van Arctische ijs- en sneeuwgegevens via AI
Hoofdlijnen
- Pareidolie:waarom we in bijna alles gezichten zien
- Kiemvrije broedeieren:een alternatief voor het gebruik van formaldehyde
- Methode stelt onderzoekers in staat lichaamsgeurmonsters van zoogdieren op een niet-invasieve manier te verzamelen
- Schimmelmicroben als biomeststoffen in landbouw en tuinieren:is de beloning groter dan het risico?
- Hoe maak je een RNA & een DNA-model
- Syngenta schikt Amerikaanse boerenrechtszaken in Chinese maïshandelzaak
- Dikke eekhoorn steelt dure goederen die zijn achtergelaten voor bezorgers
- Nidovirussen brengen overtollig genen tot expressie en coderen voor meer eiwitten dan eerder werd aangenomen, studie vondsten
- Dierenartsen verplegen zieke bobcat, breng het terug naar het park waar het nodig is
- Plasmonisch apparaat zet licht om in elektriciteit
- Cellulaire microRNA-detectie met miRacles

- Door de verdamping van silicium te beheersen, kunnen wetenschappers de grafeenkwaliteit verbeteren

- Wetenschappers kweken grafeen van hoge kwaliteit uit tea tree-extract

- Nieuw type op grafeen gebaseerde transistor zal de kloksnelheid van processors verhogen
 3D-beeldvorming van gewassen helpt de landbouw de planthoogte te schatten
3D-beeldvorming van gewassen helpt de landbouw de planthoogte te schatten Amerikaanse astronaut breekt record voor meeste ruimtewandelingen door een vrouw
Amerikaanse astronaut breekt record voor meeste ruimtewandelingen door een vrouw Een brede kijk op de nanowereld van oppervlaktekatalyse
Een brede kijk op de nanowereld van oppervlaktekatalyse Getijden stabiliseren delta's totdat mensen tussenbeide komen
Getijden stabiliseren delta's totdat mensen tussenbeide komen Vorming van organische dunnefilmtransistors door afdrukken bij kamertemperatuur
Vorming van organische dunnefilmtransistors door afdrukken bij kamertemperatuur Holistisch celontwerp leidt tot hoogwaardige, lithium-zwavelbatterij met lange levensduur
Holistisch celontwerp leidt tot hoogwaardige, lithium-zwavelbatterij met lange levensduur Wat is het verschil tussen een Avenue,
Wat is het verschil tussen een Avenue,  Nieuw onderzoek werpt licht op hoe de internationale gemeenschap de stabiliteit in post-conflictgebieden kan handhaven
Nieuw onderzoek werpt licht op hoe de internationale gemeenschap de stabiliteit in post-conflictgebieden kan handhaven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

