
Wetenschap
Bepaling van topografische stralingsdosisprofielen met behulp van gel-nanosensoren
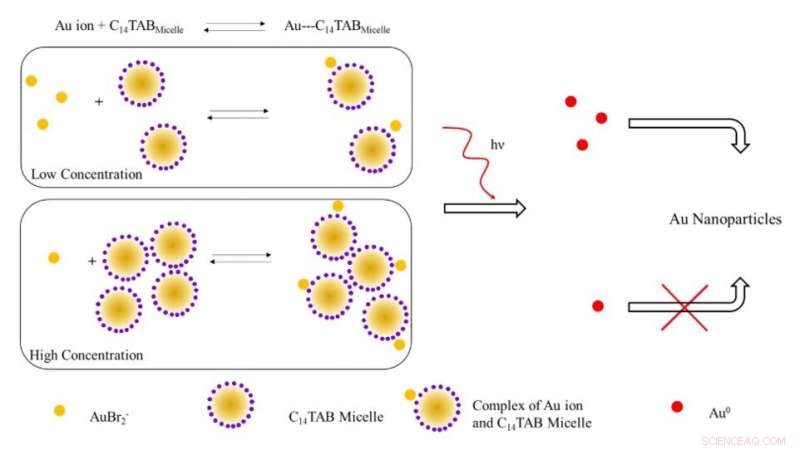
Schematische weergave van het voorgestelde mechanisme voor de vorming van gouden nanodeeltjes bij bestraling met ioniserende straling. Bij lage concentraties oppervlakteactieve stoffen, de meeste goudionen (AuBr2- /Au1+) zijn waarschijnlijk vrij in oplossing (niet gebonden aan micellen). Met toenemende concentratie oppervlakteactieve stoffen, het evenwicht verschuift naar rechts met een afname van vrije goudionen. Bij bestraling, het aantal Au^0-atomen gevormd door reductie bij een lage concentratie oppervlakteactieve stof is hoger door de aanwezigheid van een groter aantal vrije goudionen in tegenstelling tot het systeem bij een hoge concentratie oppervlakteactieve stof. Het hogere aantal vrije goudatomen leidt tot een verhoogde opbrengst aan gouden nanodeeltjes als gevolg van oppervlakteondersteunde reductie met ongereageerde goudionen. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw8704.
De routinematige meting van stralingsdoses kan klinisch een uitdaging zijn vanwege beperkingen met conventionele dosismeters die worden gebruikt om de dosisopname van externe ioniserende straling te meten. In een nieuwe studie, Karthik Pushpavanam en een interdisciplinair team van onderzoekers van de afdelingen Chemical Engineering, Moleculaire Wetenschappen, Banner MD Anderson Cancer Center en Arizona Veterinary Oncology in de VS hebben een nieuwe op gel gebaseerde nanosensor beschreven. De technologie maakt colorimetrische detectie en kwantificering van topografische stralingsdosisprofielen tijdens radiotherapie mogelijk.
Bij blootstelling aan ioniserende straling, de wetenschappers zetten goudionen in de gel om in gouden nanodeeltjes (AuNP's), vergezeld van een visuele verandering in gelkleur als gevolg van plasmonische eigenschappen. Ze gebruikten de intensiteit van de kleur gevormd in de gel als een kwantitatieve reporter voor ioniserende straling en gebruikten eerst de gel-nanosensor om complexe topografische dosispatronen te detecteren na toediening aan antropomorfe fantoommodellen, gevolgd door toepassingen met levende hondenpatiënten die klinische radiotherapie ondergaan. Het gemak van fabricage, operatie, snelle uitlezing, colorimetrische detectie en relatief lage kosten van de technologie impliceerden translationeel potentieel voor topografische dosismapping tijdens klinische radiotherapietoepassingen. Het onderzoekswerk is nu gepubliceerd op wetenschappelijke vooruitgang .
Vooruitgang in bestralingstherapie heeft geleid tot opmerkelijke verfijning en state-of-the-art planningssoftware om hoge conforme stralingsdoses aan patiënten te leveren voor een betere kwaliteit van leven na de behandeling. Tijdens radiotherapie, een hoge dosis wordt typisch afgeleverd aan een doeltumor, terwijl de stralingsdosis die aan omringend weefsel wordt afgegeven, wordt geminimaliseerd. Tijdens palliatieve zorg krijgen patiënten grotere fractionele doses toegediend om de behandeling binnen een kort tijdsbestek af te ronden. Echter, softwarefouten tijdens dergelijke procedures kunnen leiden tot overdosering en daaropvolgende morbiditeit.
Om onbedoelde overbelichting tot een minimum te beperken, onderzoekers proberen onafhankelijk de stralingsdosis te verifiëren die bij of nabij het doelweefsel wordt afgegeven voor geavanceerde patiëntveiligheid. Technisch gezien, zowel moleculaire als nanosensoren kunnen de limieten van conventionele systemen overwinnen om praktische alternatieven te vormen als gemakkelijke sensoren. Echter, hun bestaande limieten moeten worden aangepakt en verlicht om robuuste en effectieve sensoren te ontwikkelen die kwantitatief en kwalitatief de topografische dosisprofielen bepalen tijdens klinische radiotherapie.

Digitale beelden en UV-zichtbare spectra van verschillende gel-nanosensorformuleringen die zijn blootgesteld aan therapeutische doses röntgenstralen (A) Beelden van gel-nanosensoren die zijn vervaardigd in celcultuurplaten met 24 putjes en die verschillende concentraties C14TAB (24,5 tot 73,5 mM) bevatten bij blootstelling aan verschillende doses ioniserende straling (0- tot 10-Gy-röntgenstralen); Na2S wachttijd was 5 min na bestraling, en de incubatietijd was 10 minuten. Beelden werden 1 uur na bestraling verkregen. Een zichtbare toename van de intensiteit van de kastanjebruine kleur wordt waargenomen bij toenemende doses ioniserende straling voor de meeste C14TAB-concentraties die worden gebruikt tijdens de ontwikkeling van de gelsensor. (B tot F) absorptiespectra (300 tot 990 nm) van dezelfde gel-nanosensoren die (B) 24,5 mM bevatten, (C) 31 mM, (D) 37 mM, (E) 49 mM, en (F) 73,5 mM bestraald met verschillende stralingsdoses. Karakteristieke absorptiepieken tussen 500 en 600 nm golflengten zijn indicatief voor gouden nanodeeltjes gevormd in de gels. De bijbehorende stralingsdoses worden in de legenda vermeld met toenemende stralingsdosis (van boven naar beneden). AU, willekeurige eenheden. Fotocredit:Sahil Inamdar, Staatsuniversiteit van Arizona. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw8704
Omdat gouden nanodeeltjes (AuNP's) unieke fysieke en chemische eigenschappen hebben die een uitstekend platform bieden om sensoren te ontwikkelen. Pushpavanam et al. ontwierp een colorimetrische sensor waarbij ioniserende straling AuNP-vorming veroorzaakte uit kleurloze zoutprecursoren. De vorming van een op gel gebaseerde nanosensor kan eenvoudige hantering en toepassingen tijdens klinische radiotherapie mogelijk maken.
In het huidige werk, het team demonstreerde colorimetrische detectie en kwantificering van dosisverdelingsprofielen met behulp van een gel-nanosensor om stralingsdoses langs weefseloppervlakken topografisch in kaart te brengen. Tijdens preklinische evaluaties, het team diende de gel-nanosensortechnologie toe bij levende hondenpatiënten die radiotherapie ondergaan. In totaal, de resultaten gaven de reikwijdte aan van de technologie voor klinische vertaling bij menselijke patiënten en het vermogen om topografische doses te bepalen om behandelingen te plannen en doseringen te verifiëren tijdens kankerradiotherapie.
Tijdens de experimenten, de omzetting van goudionen in nanodeeltjes ging gepaard met een kastanjebruine kleurontwikkeling in het bestraalde gebied van de gel-nanosensor. Hoewel goud in het algemeen in een driewaardige staat bestaat (AuCl 4 - ) het kan worden teruggebracht tot een metastabiele +1 valentietoestand (AuBr 2 - ) bij kamertemperatuur met behulp van ascorbinezuur (vitamine C). De bestraling van gels met therapeutische stralingsniveaus stimuleerde radiolyse of de splitsing van watermoleculen in zeer reactieve vrije radicalen. De door radiolyse gegenereerde gehydrateerde elektronen reduceerden op hun beurt eenwaardig goud om goudatomen te vormen in zijn nulwaardige toestand (Au 0 ) die kiemden en rijpten tot kastanjebruin gekleurde AuNP's. De intensiteit varieerde met de stralingsdosis en het team gebruikte het bereik van lineaire reacties om de gel-nanosensor te kalibreren. Op basis van dit principe, Pushpavanam et al. bepaalde de respons van de volledig bestraalde gels om de absorptie met stralingsdosis te kalibreren.
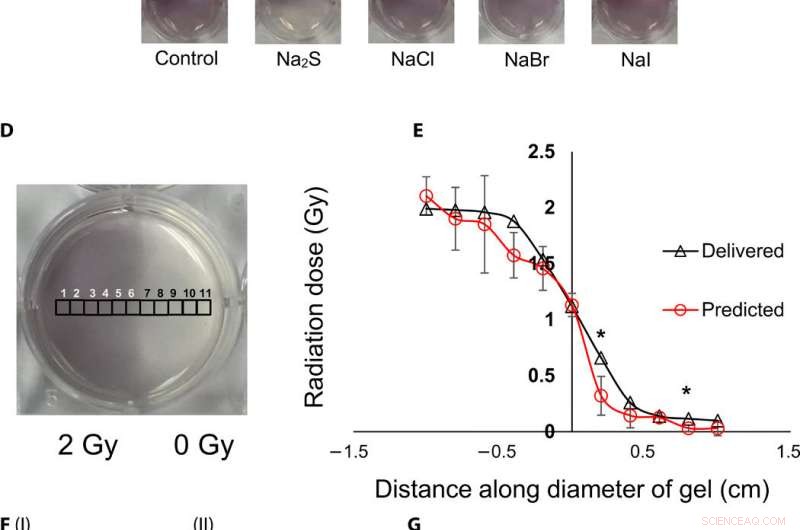
Topografische visualisatie en kwantificering van stralingsdoses met behulp van gel-nanosensoren. (A) Gel nanosensor (links) vóór bestraling, (middelste) bovenste helft bestraald met 4 Gy en beeld verkregen 2 min na bestraling, en (rechts) beeld verkregen 1 uur na bestraling. Een zichtbare toename van de kleurintensiteit in de niet-bestraalde onderste helft duidt op overvloeien van kleur en verlies van topografische informatie. (B) I:1,5% (w/v) agarosegel (links) 2 min na bestraling en (rechts) 1 uur na bestraling; II:2% (w/v) agarose gel (left) 2 min after irradiation and (right) 1 hour after irradiation indicates that the increase in agarose weight percentage does not preserve topographical dose information. (C) Gel nanosensor incubated with 5 mM sodium sulfide (Na2S) and various sodium halides with a wait time of 10 min and incubation time of 10 min; images were acquired after 1 hour. No loss of topographical information is observed upon incubation with sodium sulfide. All gels were fabricated in 24-well plates. (D) Colorimetric response of the gel nanosenor irradiated on one-half with a 2-Gy x-ray dose. A visible appearance of maroon color in the irradiated region illustrates the ability of the gel nanosensor to visualize topographical dose profiles. Each black square box (labeled 1 to 11) on the gel nanosensor corresponds to a grid of size ≈2 × 2 mm, whose absorbance at 540 nm is determined. Grids starting from 1 to 5 are regions exposed to ionizing radiation, 6 is the grid at the edge of the irradiation field, and grids from 7 to 11 are regions outside the field of irradiation. (E) Dose fall-off profile for the gel nanosensor irradiated by 2 Gy on one-half. The delivered and predicted radiation doses are comparable, which indicates the efficacy of the gel nanosensor in visualizing and retaining topographical information. In all cases, Na2S was added for 10-min incubation time after a wait time of 30 min. Radiation doses predicted by the gel nanosensor as compared with the delivered radiation dose as obtained from the treatment planning system. Asterisks indicate statistically significant differences (P <0.05) between the delivered dose and the dose predicted by the gel nanosensor (n =3 independent experiments). (F) Representative image of a petri dish containing the gel nanosensor formulation (≈3 mm thick and ≈10 cm diameter) irradiated with a 1 cm × 1 cm square field of x-ray radiation. From the left, each square indicates increasing radiation dose from (I) 0.5 Gy (red box), 1 Gy, and 1.5 Gy; (II) 2, 2.5, 3, and 3.5 Gy; and (III) 4, 4.5, and 5 Gy; the black box in image (II) shows 0 Gy. (G) Visualization of a complex topographical dose pattern (ASU letters) generated using a 2-Gy x-ray dose. The petri dish has a diameter of ≈10 cm. In (F) and (G), the gel nanosensors contain 24.5 mM C14TAB, and Na2S was added after a wait time of 30 min and incubation time of 10 min; a representative image from three independent experiments is shown. Photo credit:Sahil Inamdar, Arizona State University. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw8704.
To determine intensity of the color and dose delivered within gels after irradiation, the researchers used absorbance spectroscopy and observed a decrease in the spectral profile width, with increasing radiation dose for decreased polydispersity (ratio of the percentage of the standard deviation to the average value) of the nanoparticles. The peak absorbance intensity increased with increasing radiation dose to corroborate the observed increase in color intensity.
To understand the gel nanosensor's ability to detect topographical distribution of the radiation dose, the scientists irradiated half of the gel nanosensor with a 4 gray (Gy) dose. The maroon-color only appeared in the irradiated area confirming AuNP formation, but after one hour of exposure, the color bled into the irradiated region showing loss of topographic information in the gel with time. The team observed the phenomenon to arise from reaction-controlled conditions and not based on the gel composition. By incubating the gel with sodium sulfide (Na 2 S) for 10 minutes, they suppressed the color bleed-over and reasoned that to the ability to quench unreacted gold ions in the nonirradiated region and preserve dose information accurately for dose visualization and dosimetry. The scientists adopted the sensor for wide dose ranges by modulating the time of Na 2 S addition; to achieve a level of flexibility hitherto unavailable in clinical dose detection systems.
The research team then used the gel nanosensor to visualize diverse topographical radiation patterns, where the intensity of the color increased with increasing dose while preserving topographical integrity. As proof of concept, they showed the gel nanosensor's ability to detect complex radiation patterns with a model dose patterned to form "ASU" (after Arizona State University). Then using transmission electron microscopy (TEM), the scientists characterized the generated gold nanoparticles as a function of dose to observe reduced average nanoparticle diameter and polydispersity at higher doses of radiation. They followed this with energy dispersive X-ray spectroscopy (EDS) to detect higher yields of AuNPs in the irradiated regions of the gel nanosensor as expected.

Gel nanosensor enabled topographical detection and quantification of clinical radiation doses in anthropomorphic head and neck phantoms. (A) Anthropomorphic head and neck phantom treated with an irregularly shaped x-ray radiation field below the left eye. (B) Image of the gel nanosensor positioned on the anthropomorphic phantom in the radiation field mimicking a conventional radiotherapy session. (C) Axial view of the treatment planning image along the central axis of the radiation beam representing an irregularly shaped radiation field used to deliver a complex radiation pattern under the eye of the phantom. The core of the crescent-shaped treatment region receives a radiation dose of 2.3 Gy (highlighted in red), and regions receiving lower doses are highlighted with different colors going outward (from green to light pink). (D) Visual image of the dose pattern on the gel nanosensor formed after delivery of 2.3 Gy. Only the irradiated region develops a maroon color, while the nonirradiated region remains colorless. (E) Expected topographical dose “heat map” profile of the radiation dose delivered to the gel placed in the phantom. The expected profile is generated from the treatment plan in the dose delivery system. In these figures, red and blue colors indicate higher and lower radiation doses, respectievelijk. (F) Topographical doses predicted by the irradiated gel nanosensor. Absorbance values of ≈2 mm × 2 mm grids were quantified using a calibration curve to generate the topographical dose profile. The anticipated dose received by the core of the crescent-shaped profile (2.3 Gy) is comparable to the dose profile predicted by the gel nanosensor (2.3 Gy), which demonstrates the capability of the gel nanosensor to qualitatively and quantitatively detect complex topographical dose profiles. Photo credit:Sahil Inamdar, Arizona State University. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw8704.
To investigate translational potential of the gel nanosensor and predict topographical profiles of radiation, Pushpavanam et al. first used a head and neck phantom model. They delivered an irregular crescent-shaped radiation dose near the eye to mimic clinically challenging administration modes of radiotherapy close to critical structures such as the eye during skin cancer treatment. The dose profile delivered using the treatment planning system was in excellent agreement with the predictions of the gel nanosensor. Indicating its capability to detect and predict complex radiation patterns similar to those used in clinical human radiotherapy.
During preclinical studies, the research team used two canine models undergoing radiotherapy to investigate the efficiency of gel nanosensors as independent, nanoscale radiation dosimeters for the first time and compared the efficiency with conventional clinical radiochromic films. On completion of the treatment, Pushpavanam et al. observed maroon color formation in one-half of the gel, whereas the non-irradiated region remained colorless. They showed predictions of the gel nanosensor in the irradiated region to agree excellently with the treatment planning system and the radiochromic film. The gel nanosensor also predicted for the region external to the irradiation to receive minimal radiation and their topographical dose profiles as well. The performance was comparable to clinical radiochromic films but with faster than conventional wait times (typically> 24 hours) to obtain the results. The scientists demonstrated the simplicity of fabrication, operation, readout time and cost effectiveness ($ 0.50 per gel material only) of the frugal invention. They maintained the response of the gel nanosensor for at least seven days to indicate long-term retrieval of dosing data unlike with fluorescence-based dosimeters with readouts that lasts mere minutes.
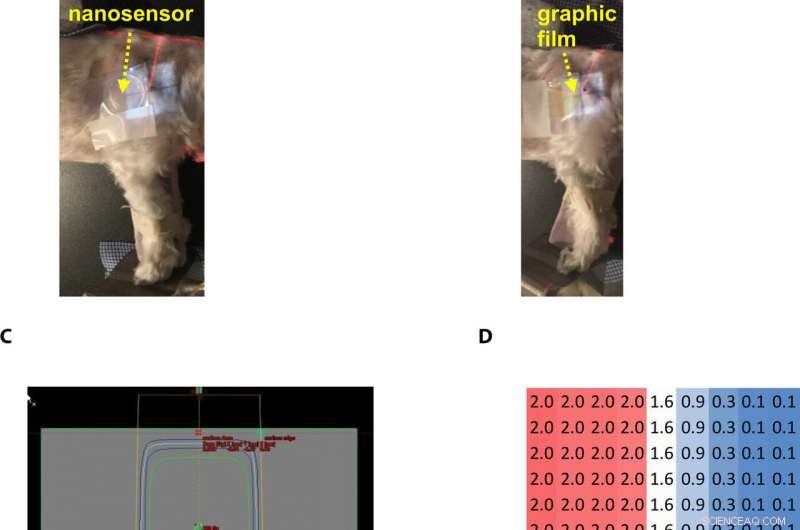
Gel nanosensor enabled topographical detection and quantification of radiation delivered to canine patient A undergoing clinical radiotherapy. Representative image of (A) half of the gel nanosensor and (B) half of the radiographic film positioned in the radiation field delivered to canine patient A. (C) Treatment planning software depicting the delivery of a 2-Gy dose delivered to the surface of patient A (neon green edge along the rectangular gray box indicates the region receiving the 2-Gy dose). (D) The irradiated region received a dose of 2 Gy (highlighted in red squares), with irradiation dose dropping to a minimal radiation 0.1 Gy (highlighted in blue squares) outside the field of irradiation. A color change is visible in both the (E) gel nanosensor whose color changes to maroon and (F) radiographic film whose color changes to dark green after irradiation. The predicted dose map in the gel nanosensor (Na2S addition wait time of 30 min and incubation time of 10 min) and radiographic film are shown below each corresponding sensor. Similarity in the dose profiles indicates the efficacy of the gel nanosensor for clinical dosimetry. The time for readout of the gel nanosensor was 1 hour after irradiation, while the radiochromic film required>24 hours of developing time before readout. All experiments were carried out three independent times. Photo credit:Sahil Inamdar, Arizona State University. Krediet:wetenschappelijke vooruitgang, doi:10.1126/sciadv.aaw8704.
Op deze manier, Karthik Pushpavanam and colleagues developed the first colorimetric gel nanosensor as a nanoscale dosimeter to detect and distinguish regions exposed to irradiation. They optimized the platform with a chemical quenching agent (Na 2 S) to accurately reveal topographical dose distribution during clinical radiotherapy. The scientists can control the pore size distribution of the gel substrate to enhance efficacy of the nanosensor. They tested the efficiency of the gel nanosensor to predict complex topographical dose profiles in anthromorphic head and neck phantoms and in live canine patients undergoing radiotherapy. The highly disruptive and translational potential of the gel nanosensor technology will lead to improved patient safety and outcomes in clinical radiotherapy.
© 2019 Wetenschap X Netwerk
 Hard als keramiek, sterk als staal:nieuw ontdekte verbinding kan helpen bij het ontwerpen van nextgen legeringen
Hard als keramiek, sterk als staal:nieuw ontdekte verbinding kan helpen bij het ontwerpen van nextgen legeringen Hoe percentages te berekenen
Hoe percentages te berekenen  Onderzoekers rapporteren een temperatuurgevoelige gel die vocht absorbeert en afgeeft
Onderzoekers rapporteren een temperatuurgevoelige gel die vocht absorbeert en afgeeft Door licht geactiveerde kankermedicijnen zonder toxische bijwerkingen
Door licht geactiveerde kankermedicijnen zonder toxische bijwerkingen Onderzoek naar celisolatie levert veelbelovende resultaten op
Onderzoek naar celisolatie levert veelbelovende resultaten op
 Klimaatverandering en brandbestrijding
Klimaatverandering en brandbestrijding Welke invloed heeft de zon op planten?
Welke invloed heeft de zon op planten?  Wonen in de buurt van bossen is goed voor de geestelijke gezondheid van kinderen en jongeren
Wonen in de buurt van bossen is goed voor de geestelijke gezondheid van kinderen en jongeren Klimaatverandering zal naar verwachting de schadelijke algenbloei in zoetwater in de VS aanzienlijk doen toenemen
Klimaatverandering zal naar verwachting de schadelijke algenbloei in zoetwater in de VS aanzienlijk doen toenemen Wat zijn goede protisten?
Wat zijn goede protisten?
Hoofdlijnen
- Saguaro en andere torenhoge cactussen hebben een roerige geschiedenis
- Virtuele kusten verbeteren het begrip van mogelijke uitkomsten van kustplanning
- Anatomische structuren: homoloog, analoog & vestigiaal
- Genetische variabiliteit ondersteunt de overleving van planten tijdens droogtes
- Vetmolecuul in menselijk bloed controleert malariaparasieten beslissing om op muggen te springen
- Lijst met genotypes
- Een zwaartekrachttheorie ontwikkelen voor ecologie
- Wat zijn Darwins vier belangrijkste ideeën over evolutie?
- Hoe is een Cells DNA net als de boeken in een bibliotheek?
- Rekbare nano-apparaten richting slimme contactlenzen

- Zeldzaam element om beter materiaal te leveren voor high-speed elektronica

- Verbeterd polymeer en nieuwe assemblagemethode voor ultraconforme elektronische tattoo-apparaten

- Snel, betaalbare oplossing voorgesteld voor transparante displays en halfgeleiders

- Onderzoek in landplanten laat zien dat nanoplastics zich ophopen in weefsels

 Team ontwikkelt nieuwe supergeleidende hybride kristallen
Team ontwikkelt nieuwe supergeleidende hybride kristallen SLAP:gelijktijdige lokalisatie en planning voor autonome robots
SLAP:gelijktijdige lokalisatie en planning voor autonome robots Een waterfilter maken met zand en stenen
Een waterfilter maken met zand en stenen  Technologie is beter dan ooit - maar elk jaar sterven nog steeds duizenden Amerikanen bij auto-ongelukken
Technologie is beter dan ooit - maar elk jaar sterven nog steeds duizenden Amerikanen bij auto-ongelukken Luchtvervuiling veroorzaakt 160, 000 doden in grote steden vorig jaar:NGO
Luchtvervuiling veroorzaakt 160, 000 doden in grote steden vorig jaar:NGO EU onthult nieuwe consumentenbescherming na dieselgate-schandaal
EU onthult nieuwe consumentenbescherming na dieselgate-schandaal Het gebrek aan tekenvermogen van Neanderthalers kan verband houden met jachttechnieken
Het gebrek aan tekenvermogen van Neanderthalers kan verband houden met jachttechnieken Beeldvorming met hoge resolutie met conventionele microscopen
Beeldvorming met hoge resolutie met conventionele microscopen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

