
Wetenschap
Beeldvorming met hoge resolutie met conventionele microscopen
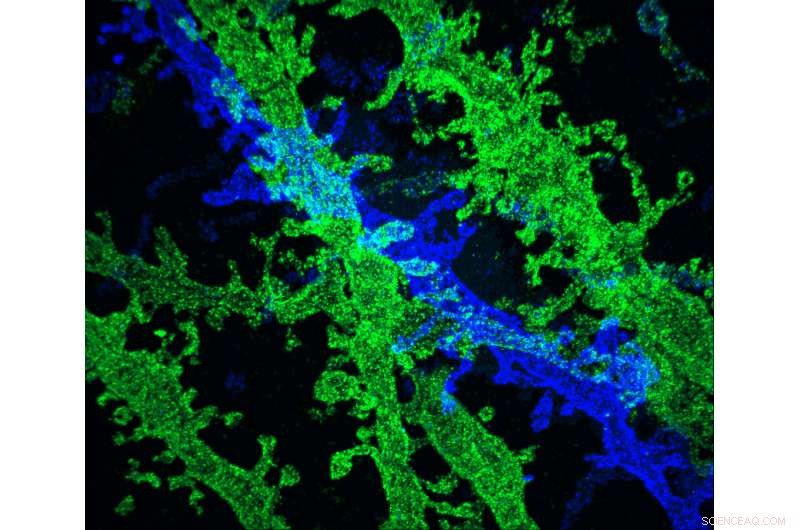
MIT-onderzoekers hebben een manier ontwikkeld om weefselmonsters met extreem hoge resolutie te maken, tegen een fractie van de kosten van andere technieken die een vergelijkbare resolutie bieden. Krediet:de onderzoekers
MIT-onderzoekers hebben een manier ontwikkeld om weefselmonsters met extreem hoge resolutie te maken, tegen een fractie van de kosten van andere technieken die een vergelijkbare resolutie bieden.
De nieuwe techniek is gebaseerd op het uitzetten van weefsel voordat het wordt afgebeeld met een conventionele lichtmicroscoop. Twee jaar geleden, het MIT-team toonde aan dat het mogelijk was om weefselvolumes 100-voudig uit te breiden, wat resulteert in een beeldresolutie van ongeveer 60 nanometer. Nutsvoorzieningen, de onderzoekers hebben aangetoond dat het een tweede keer uitzetten van het weefsel voor beeldvorming de resolutie kan verhogen tot ongeveer 25 nanometer.
Met dit resolutieniveau kunnen wetenschappers zien, bijvoorbeeld, de eiwitten die samenklonteren in complexe patronen bij hersensynapsen, neuronen helpen om met elkaar te communiceren. Het kan onderzoekers ook helpen om neurale circuits in kaart te brengen, zegt Ed Boyden, een universitair hoofddocent biologische engineering en hersen- en cognitieve wetenschappen aan het MIT.
"We willen de bedrading van complete hersencircuits kunnen traceren, " zegt Boyden, senior auteur van de studie. "Als je een compleet hersencircuit zou kunnen reconstrueren, misschien kun je een rekenmodel maken van hoe het complexe fenomenen genereert, zoals beslissingen en emoties. Omdat je de biomoleculen in kaart kunt brengen die elektrische pulsen in cellen genereren en die chemicaliën tussen cellen uitwisselen, je zou mogelijk de dynamiek van de hersenen kunnen modelleren."
Deze benadering kan ook worden gebruikt om andere fenomenen in beeld te brengen, zoals de interacties tussen kankercellen en immuuncellen, om ziekteverwekkers op te sporen zonder dure apparatuur, en om de celtypen van het lichaam in kaart te brengen.
Voormalig MIT-postdoc Jae-Byum Chang is de eerste auteur van het artikel, die verschijnt in het nummer van 17 april van Natuurmethoden .
Dubbele uitbreiding
Om weefselmonsters uit te breiden, de onderzoekers verankeren ze in een dichte, gelijkmatig gegenereerde gel van polyacrylaat, een zeer absorberend materiaal dat ook in luiers wordt gebruikt. Voordat de gel wordt gevormd, de onderzoekers labelen de celeiwitten die ze willen verbeelden, met behulp van antilichamen die binden aan specifieke doelen. Deze antilichamen dragen "barcodes" gemaakt van DNA, die op hun beurt zijn gehecht aan verknopende moleculen die binden aan de polymeren waaruit de expandeerbare gel bestaat. De onderzoekers breken dan de eiwitten af die normaal het weefsel bij elkaar houden, waardoor de DNA-barcodes van elkaar kunnen uitzetten terwijl de gel opzwelt.
Deze vergrote monsters kunnen vervolgens worden gelabeld met fluorescerende sondes die de DNA-barcodes binden, en afgebeeld met in de handel verkrijgbare confocale microscopen, waarvan de resolutie meestal beperkt is tot honderden nanometers.
Met behulp van die aanpak, de onderzoekers haalden eerder een resolutie van zo'n 60 nanometer. Echter, "Individuele biomoleculen zijn veel kleiner dan dat, zeg 5 nanometer of zelfs kleiner, " zegt Boyden. "De originele versies van expansiemicroscopie waren nuttig voor veel wetenschappelijke vragen, maar konden de prestaties van de beeldvormingsmethoden met de hoogste resolutie zoals elektronenmicroscopie niet evenaren."
In hun oorspronkelijke expansiemicroscopie-onderzoek, de onderzoekers ontdekten dat ze het weefsel meer dan 100-voudig in volume konden uitbreiden door het aantal verknopende moleculen te verminderen die het polymeer in een ordelijk patroon houden. Echter, dit maakte het weefsel onstabiel.
"Als je de dichtheid van crosslinkers verlaagt, de polymeren behouden hun organisatie niet meer tijdens het expansieproces, " zegt Boyden, die lid is van MIT's Media Lab en McGovern Institute for Brain Research. "Je verliest de informatie."
In plaats daarvan, in hun laatste studie, de onderzoekers pasten hun techniek zo aan dat na de eerste weefselexpansie, ze kunnen een nieuwe gel maken die het weefsel voor de tweede keer opzwelt - een benadering die ze 'iteratieve expansie' noemen.
Circuits in kaart brengen
Met behulp van iteratieve expansie, konden de onderzoekers weefsels in beeld brengen met een resolutie van ongeveer 25 nanometer, wat vergelijkbaar is met wat wordt bereikt door technieken met hoge resolutie zoals stochastische optische reconstructiemicroscopie (STORM). Echter, expansiemicroscopie is veel goedkoper en eenvoudiger uit te voeren omdat er geen gespecialiseerde apparatuur of chemicaliën nodig zijn, zegt Boyden. De methode is ook veel sneller en dus compatibel met grootschalige, 3D beeldvorming.
De resolutie van expansiemicroscopie komt nog niet overeen met die van scanning-elektronenmicroscopie (ongeveer 5 nanometer) of transmissie-elektronenmicroscopie (ongeveer 1 nanometer). Echter, elektronenmicroscopen zijn erg duur en niet overal verkrijgbaar, en met die microscopen, het is voor onderzoekers moeilijk om specifieke eiwitten te labelen.
In de Natuurmethoden papier, het MIT-team gebruikte iteratieve expansie om synapsen in beeld te brengen - de verbindingen tussen neuronen waardoor ze met elkaar kunnen communiceren. In hun oorspronkelijke expansiemicroscopie-onderzoek, konden de onderzoekers steigereiwitten in beeld brengen, die helpen bij het organiseren van de honderden andere eiwitten die in synapsen worden gevonden. Met de nieuwe, verbeterde resolutie, de onderzoekers konden ook fijnere structuren zien, zoals de locatie van neurotransmitterreceptoren op de oppervlakken van de "postsynaptische" cellen aan de ontvangende zijde van de synaps.
"Mijn hoop is dat we kunnen, in de komende jaren, echt beginnen met het in kaart brengen van de organisatie van deze steiger- en signaaleiwitten bij de synaps, ' zegt Boyden.
Het combineren van expansiemicroscopie met een nieuwe tool genaamd temporale multiplexing zou moeten helpen om dat te bereiken, hij gelooft. Momenteel, slechts een beperkt aantal gekleurde sondes kan worden gebruikt om verschillende moleculen in een weefselmonster af te beelden. Met temporele multiplexing, onderzoekers kunnen één molecuul labelen met een fluorescerende sonde, maak een foto, en spoel de sonde vervolgens weg. Dit kan dan vele malen worden herhaald, elke keer dezelfde kleuren gebruiken om verschillende moleculen te labelen.
"Door iteratieve expansie te combineren met temporele multiplexing, we zouden in principe oneindig veel kleuren kunnen hebben, beeldvorming op nanoschaal over grote 3D-volumes, Boyden zegt. "Het wordt echt spannend nu deze verschillende technologieën binnenkort met elkaar in contact kunnen komen."
De onderzoekers hopen ook op een derde uitbreidingsronde, waarvan ze denken dat het kan, in principe, resolutie van ongeveer 5 nanometer mogelijk maken. Echter, op dit moment wordt de resolutie beperkt door de grootte van de antilichamen die worden gebruikt om moleculen in de cel te labelen. Deze antilichamen zijn ongeveer 10 tot 20 nanometer lang, dus om een resolutie daaronder te krijgen, onderzoekers zouden eerst kleinere tags moeten maken of de eiwitten eerst uit elkaar moeten halen en vervolgens de antilichamen na expansie moeten afleveren.
 Microscopische strijdwagens leveren moleculen in onze cellen
Microscopische strijdwagens leveren moleculen in onze cellen Wetenschappers maximaliseren de effectiviteit van platina in brandstofcellen
Wetenschappers maximaliseren de effectiviteit van platina in brandstofcellen Fysische eigenschappen van piepschuim
Fysische eigenschappen van piepschuim Zwevend in de zomer met meer drijfvermogen, vloeistofdichte reddingsvesten en zwemkleding
Zwevend in de zomer met meer drijfvermogen, vloeistofdichte reddingsvesten en zwemkleding Welk soort warmteoverdracht doet zich voor in vloeistoffen & gassen?
Welk soort warmteoverdracht doet zich voor in vloeistoffen & gassen?
 Tyfoon Trami gewond 50, klaart voltreffer op het vasteland van Japan
Tyfoon Trami gewond 50, klaart voltreffer op het vasteland van Japan De rol van decomposers in een mangrove-ecosysteem
De rol van decomposers in een mangrove-ecosysteem  National Park Service annuleert gecontroleerde verbranding bij de grootste boom op aarde
National Park Service annuleert gecontroleerde verbranding bij de grootste boom op aarde Californië voorkomt meer stroomuitval te midden van hittegolf
Californië voorkomt meer stroomuitval te midden van hittegolf Virus, orkaanseizoen vertraging verwijdering van vergaan vrachtschip
Virus, orkaanseizoen vertraging verwijdering van vergaan vrachtschip
Hoofdlijnen
- Cytoplasma: definitie, structuur en functie (met diagram)
- Wetenschappers ontdekken dat de meeste blauwe vinvissen rechtshandig zijn, behalve wanneer ze omhoog zwemmen
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Relatie tussen DNA en natuurlijke selectie
- Hoe is mitose van invloed op het leven?
- De celstructuur van een ui
- Het is wiskundig onmogelijk om veroudering te verslaan, wetenschappers zeggen:
- Race om Indonesische krokodil te redden die is getroffen door een bandenketting
- Parasitisme: definitie, types, feiten en voorbeelden
- Supergeleiding in een legering met quasikristalstructuur

- Nieuwe methode gebruikt ruis om spectrometers nauwkeuriger te maken

- Inzoomen op de ware aard van vloeistoffen in nanocapillairen
- Magnetisch grafeen vormt een nieuw soort magnetisme
- Natuurkundigen gaan nieuwe röntgendiagnostiek maken voor het WEST-fusieapparaat in Frankrijk

 Wat gebeurt er met cellen vanwege een natriumbalans?
Wat gebeurt er met cellen vanwege een natriumbalans?  Instructies voor het bouwen van een losbarstig model van Mt. Vesuvius
Instructies voor het bouwen van een losbarstig model van Mt. Vesuvius  Hadden de oude Maya's parken?
Hadden de oude Maya's parken? Schatting van een verticale pijp
Schatting van een verticale pijp Nieuwe katalysator verbetert de efficiëntie van de productie van geneesmiddelen en pesticiden
Nieuwe katalysator verbetert de efficiëntie van de productie van geneesmiddelen en pesticiden De krachtigste ruimtetelescoop ooit gebouwd zal terugkijken in de tijd naar de donkere middeleeuwen van het universum
De krachtigste ruimtetelescoop ooit gebouwd zal terugkijken in de tijd naar de donkere middeleeuwen van het universum Stichting om speciaal reservaat te creëren voor albino orang-oetan
Stichting om speciaal reservaat te creëren voor albino orang-oetan Een stap dichter bij een waterstofeconomie met een efficiënte anode voor het splitsen van water
Een stap dichter bij een waterstofeconomie met een efficiënte anode voor het splitsen van water
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

